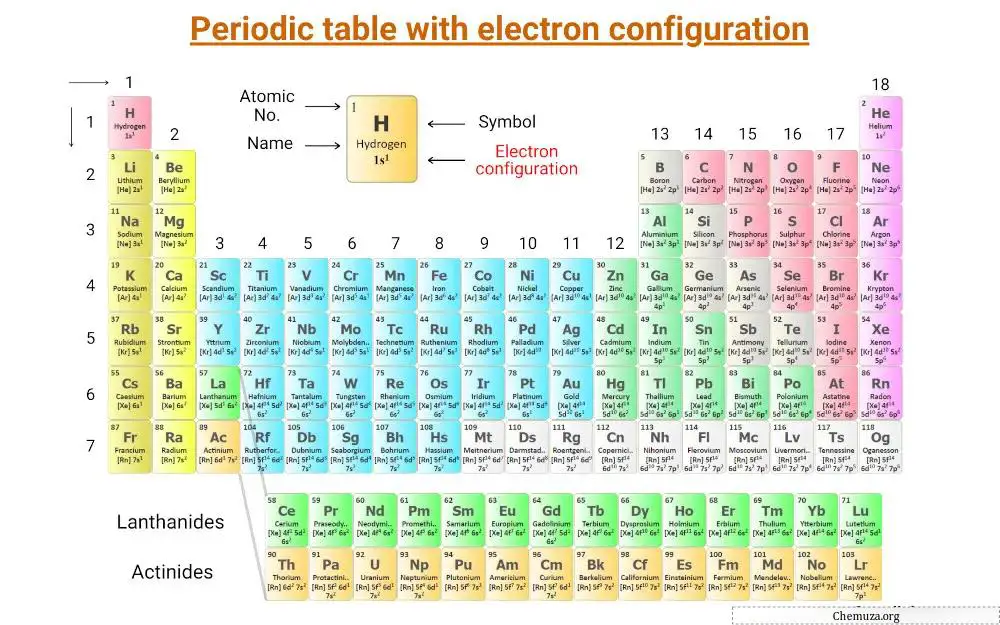
원소의 전자적 구성을 나타내는 주기율표 이다.
여기에서 HD 이미지를 다운로드할 수도 있습니다.
요소의 전자 구성을 더 자세히 살펴보겠습니다.
전자 구성이란 무엇입니까?
전자 구성은 원자 내 전자의 배열을 나타냅니다.
전자는 원자의 양전하 핵 주위를 공전하는 작은 음전하 입자입니다.
원자의 전자 구성은 반응성, 전도도, 녹는점과 같은 화학적, 물리적 특성을 결정합니다.
원자 내 전자의 배열은 에너지 수준 (껍질이라고도 함)과 해당 껍질 내의 특정 하위 껍질에 의해 결정됩니다.
전자 구성은 일반적으로 각 껍질과 하위 껍질의 전자 수를 나타내는 표기법을 사용하여 표현되며 양자역학 원리에 기초한 특정 규칙을 따릅니다.
쉘(n)과 서브쉘(s, p, d, f)이란 무엇입니까?
껍질 : 껍질은 전자가 원자핵 주위를 회전하는 궤도입니다.
각 쉘에는 번호(n)가 할당되며, 첫 번째 쉘의 경우 1부터 시작하여 추가 쉘이 추가될 때마다 증가합니다.
첫 번째 껍질에는 최대 2개의 전자만 담을 수 있고, 두 번째 껍질에는 최대 8개의 전자를 담을 수 있으며, 다음 껍질에는 더 많은 전자를 담을 수 있습니다.
하위 껍질(또는 궤도): 각 껍질에는 s, p, d 및 f와 같은 문자를 사용하여 레이블이 지정된 다양한 하위 껍질이 있습니다.
s 부껍질에는 전자 2개, p 부껍질에는 전자 6개, d 부껍질에는 전자 10개, f 부껍질에는 전자 14개가 들어갈 수 있습니다. [1]
원자의 층과 하위층은 전자 구성을 결정하고, 이는 다시 화학적, 물리적 특성을 결정합니다.
요소의 전자 구성(목록)
다음은 주기율표의 처음 20개 원소의 전자 구성 목록입니다.
| 원자 번호 | 요소 | 전자 구성 |
| 1 | 수소(H) | 1초 1 |
| 2 | 헬륨(He) | 1초 2 |
| 삼 | 리튬(Li) | [그것] 2초 1 |
| 4 | 베릴륨(Be) | [그] 2대 2 |
| 5 | 붕소(B) | [그것] 2초 2 2p 1 |
| 6 | 탄소(C) | [그] 2s 2 2p 2 |
| 7 | 질소(N) | [그] 2s 2 2p 3 |
| 8 | 산소(O) | [그] 2s 2 2p 4 |
| 9 | 형석(F) | [그것] 2초 2 2p 5 |
| 십 | 네온(Ne) | [그] 2s 2 2p 6 |
| 11 | 나트륨(Na) | [마] 3초 1 |
| 12 | 마그네슘(Mg) | [마] 3초 2 |
| 13 | 알루미늄(Al) | [마] 3초 2 3p 1 |
| 14 | 실리콘(Si) | [하지마] 3s 2 3p 2 |
| 15 | 인(P) | [하지마] 3s 2 3p 3 |
| 16 | 유황(S) | [마] 3초 2 3p 4 |
| 17 | 염소(Cl) | [하지 마세요] 3s 2 3p 5 |
| 18 | 아르곤(Ar) | [마] 3초 2 3p 6 |
| 19 | 칼륨(K) | [Ar] 4s 1 |
| 20 | 칼슘(Ca) | [Ar] 4s 2 |
