Il cloruro di ferro (III) è un composto formato dalla combinazione di ferro e cloro. Viene utilizzato come catalizzatore, nel trattamento delle acque e come reagente nelle reazioni chimiche.
| Nome IUPAC | Cloruro di ferro (III). |
| Formula molecolare | FeCl₃ |
| numero CAS | 7705-08-0 |
| Sinonimi | Cloruro ferrico, tricloruro di ferro, triclorofer |
| InChI | InChI=1S/ClH.3Fe/h1H;;;/q;;3*+3/p-3 |
Proprietà del cloruro di ferro (III).
Formula del cloruro di ferro (III).
La formula del tricloruro di ferro è FeCl₃. Rappresenta la combinazione di un atomo di ferro (Fe) e tre atomi di cloro (Cl). Questa formula indica il rapporto stechiometrico di ciascun elemento nel composto.
Massa molare del cloruro di ferro (III).
La massa molare del tricloruro di ferro si calcola sommando le masse atomiche di tutti i suoi elementi costitutivi. Il ferro ha una massa atomica di 55.845 g/mol, mentre il cloro ha una massa atomica di 35.453 g/mol. Moltiplicando la massa atomica del ferro per uno e la massa atomica del cloro per tre si ottiene una massa molare di 162,204 g/mol per il tricloruro di ferro.
Punto di ebollizione del cloruro di ferro (III).
Il tricloruro di ferro ha un punto di ebollizione di circa 315°C (599°F). A questa temperatura il composto subisce una transizione di fase da liquido a gassoso. Il punto di ebollizione è una misura della pressione di vapore esercitata dalla sostanza quando la sua temperatura raggiunge un valore specifico.
Punto di fusione del cloruro di ferro (III).
Il punto di fusione del tricloruro di ferro è di circa 306°C (583°F). Questa temperatura rappresenta il punto in cui il composto solido si trasforma in un liquido. Il punto di fusione è una proprietà caratteristica di una sostanza e ne consente l’identificazione.
Densità del cloruro di ferro(III) g/mL
La densità del tricloruro di ferro è di circa 2,90 g/mL. La densità è definita come la massa di una sostanza per unità di volume. La densità del tricloruro di ferro indica che si tratta di un composto relativamente denso.
Peso molecolare del cloruro di ferro (III).
Il peso molecolare del tricloruro di ferro si calcola sommando i pesi atomici dei suoi elementi costitutivi. Con un atomo di ferro del peso di 55,845 g/mol e tre atomi di cloro del peso di 35,453 g/mol ciascuno, il peso molecolare del tricloruro di ferro è 162,204 g/mol.
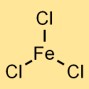
Struttura del cloruro di ferro (III).
Il tricloruro di ferro ha una struttura reticolare cristallina. Forma un legame ionico, con l’atomo di ferro (Fe³⁺) che attrae tre ioni cloro (Cl⁻). Il composto risultante adotta una disposizione cristallina in cui gli ioni ferro caricati positivamente sono circondati da ioni cloruro caricati negativamente.
Solubilità del cloruro di ferro (III).
Il tricloruro di ferro è solubile in acqua, etanolo e altri solventi polari. Quando disciolto in acqua, subisce dissociazione, formando cationi Fe³⁺ e anioni Cl⁻. La solubilità del tricloruro di ferro in acqua è influenzata da fattori quali temperatura e concentrazione, con temperature e concentrazioni più elevate che determinano una maggiore solubilità.
| Aspetto | Solido giallo-marrone |
| Peso specifico | 2,90 g/ml |
| Colore | Giallo marrone |
| Odore | Inodore |
| Massa molare | 162.204 g/mole |
| Densità | 2,90 g/ml |
| Punto di fusione | 306°C (583°F) |
| Punto di ebollizione | 315°C (599°F) |
| Punto flash | Non applicabile |
| solubilità in acqua | Solubile, influenzato da fattori quali temperatura e concentrazione |
| Solubilità | Solubile in solventi polari |
| Pressione del vapore | Non disponibile |
| Densità del vapore | Non disponibile |
| pKa | Non disponibile |
| pH | Acido (circa 2) |
Sicurezza e pericoli del cloruro di ferro (III).
Il tricloruro di ferro presenta alcune considerazioni e pericoli sulla sicurezza. È corrosivo e può causare gravi irritazioni alla pelle e agli occhi. L’inalazione delle sue polveri o dei suoi fumi può causare irritazione delle vie respiratorie. È fondamentale maneggiare questo composto con cautela, indossando adeguati dispositivi di protezione come guanti e occhiali di sicurezza. Evitare il contatto diretto e l’inalazione della sostanza. In caso di contatto con la pelle o con gli occhi, sciacquare abbondantemente con acqua e, se necessario, consultare un medico. Il tricloruro di ferro deve essere conservato in un contenitore ermeticamente chiuso, lontano da sostanze incompatibili. Seguire le corrette procedure di smaltimento per evitare la contaminazione ambientale.
| Simboli di pericolo | Corrosivo (C) |
| Descrizione della sicurezza | Provoca gravi ustioni cutanee e lesioni oculari. |
| Numeri di identificazione delle Nazioni Unite | UN3264 |
| Codice SA | 2827.39.60 |
| Classe di pericolo | 8 |
| Gruppo di imballaggio | II |
| Tossicità | Moderatamente tossico per l’uomo |
Metodi per la sintesi del cloruro di ferro (III).
Esistono vari metodi per sintetizzare il tricloruro di ferro.
Un metodo comune prevede la reazione tra ferro e cloro gassoso. In un ambiente controllato, come un reattore, la limatura di ferro o la polvere di ferro si combinano con il cloro gassoso ad alte temperature, solitamente tra 300 e 500 ° C (da 572 a 932 ° F), avviate dal riscaldamento della miscela. Il ferro reagisce con il cloro , formando tricloruro di ferro.
Un altro metodo prevede la reazione tra ossido di ferro, solitamente ossido di ferro (III) (Fe₂O₃), e acido cloridrico (HCl) . Per favorire la reazione, l’acido cloridrico scioglie l’ossido di ferro e la miscela viene riscaldata. Mentre la reazione continua, forma tricloruro di ferro rilasciando acqua.
È possibile ottenere il tricloruro di ferro anche facendo reagire direttamente il ferro con acido cloridrico concentrato. L’aggiunta di ferro alla soluzione acida avvia la reazione, che continua con il rilascio di idrogeno gassoso. Il riscaldamento della miscela risultante facilita la conversione del ferro in tricloruro di ferro.
È importante notare che questi metodi di sintesi dovrebbero essere eseguiti con adeguate precauzioni di sicurezza e in aree ben ventilate, poiché alcune reazioni comportano l’uso di sostanze corrosive e la generazione di gas tossici.
Usi del cloruro di ferro (III).
Il tricloruro di ferro trova applicazioni in vari campi grazie alle sue proprietà versatili. Ecco alcuni usi comuni:
- Trattamento dell’acqua: la coagulazione nei processi di trattamento dell’acqua utilizza ampiamente il tricloruro di ferro per rimuovere impurità e particelle sospese, rendendo l’acqua potabile.
- Mordenzante: l’industria elettronica utilizza il tricloruro di ferro come mordenzante per produrre circuiti stampati, incidere selettivamente il rame e consentire la creazione di progetti di circuiti.
- Catalizzatore: il tricloruro di ferro catalizza varie reazioni chimiche, inclusa la sintesi di composti organici e la clorurazione di composti aromatici.
- Produzione di pigmenti: la produzione di vari pigmenti, come il blu di ferro e i toner utilizzati negli inchiostri da stampa, prevede l’uso di tricloruro di ferro.
- Produzione di coloranti: la sintesi dei coloranti, soprattutto per la colorazione di tessuti, pelle e carta, utilizza il tricloruro di ferro.
- Trattamento superficiale dei metalli: il miglioramento della resistenza alla corrosione dei metalli, come l’alluminio e l’acciaio inossidabile, prevede l’uso del tricloruro di ferro come agente di trattamento superficiale.
- Reagente di laboratorio: il tricloruro di ferro è comunemente usato come reagente di laboratorio per vari scopi analitici e sintetici.
- Applicazioni medicinali: la preparazione di alcuni prodotti farmaceutici, come integratori di ferro e farmaci utilizzati nel trattamento dell’anemia, utilizza il tricloruro di ferro a scopo medicinale.
- Fotografia: il tricloruro di ferro funge da agente tonificante nei processi fotografici, creando tonalità seppia nella fotografia in bianco e nero.
- Industria tessile: la mordenzatura e la tintura dei tessuti nell’industria tessile utilizzano il tricloruro di ferro per migliorare la solidità del colore e l’assorbimento del colorante.
Queste diverse applicazioni evidenziano l’importanza del tricloruro di ferro in diversi settori industriali e campi scientifici.
Domande:
D: Qual è la massa molare del cloruro di ferro (III), FeCl₃?
R: La massa molare del tricloruro di ferro è 162,204 g/mol.
D: Quanti atomi di ferro ci sono in un’unità della formula del cloruro di ferro (III)?
R: C’è un atomo di ferro in un’unità della formula di tricloruro di ferro.
D: Qual è la formula del cloruro di ferro (III)?
R: La formula del tricloruro di ferro è FeCl₃.
D: Qual è la composizione percentuale in massa del ferro nel cloruro di ferro (III)?
R: La composizione percentuale in massa del ferro nel tricloruro di ferro è di circa il 34,8%.
D: Qual è la formula del cloruro di ferro (III)?
R: La formula del tricloruro di ferro è FeCl₃.
D: Qual è la massa molare del cloruro di ferro (III)?
R: La massa molare del tricloruro di ferro è 162,204 g/mol.
D: Come produrre il cloruro di ferro (III)?
R: Il tricloruro di ferro può essere prodotto facendo reagire il ferro con cloro gassoso o sciogliendo l’ossido di ferro in acido cloridrico.
D: Il cloruro di ferro (III) è acido?
R: Sì, il tricloruro di ferro è acido e può abbassare il pH di una soluzione.
D: Quali sono i prodotti della reazione tra lo zinco metallico e il cloruro di ferro (III)?
R: La reazione tra zinco metallico e tricloruro di ferro produce cloruro di zinco e ferro metallico.
D: Il cloruro di ferro (III) è tossico?
R: Il tricloruro di ferro è moderatamente tossico per l’uomo e può causare irritazione alla pelle e agli occhi.
D: Il cloruro di ferro (III) è dannoso per l’ambiente?
R: Il tricloruro di ferro può essere dannoso per l’ambiente se rilasciato in grandi quantità perché può contaminare le fonti d’acqua e influenzare la vita acquatica.
D: Come posso rimuovere il cloruro di ferro (III)?
R: Il tricloruro di ferro deve essere smaltito correttamente in conformità con le normative locali per lo smaltimento dei rifiuti pericolosi. Rivolgersi alle autorità competenti per un consiglio.
D: Qual è la massa molare del cloruro di ferro (III)?
R: La massa molare del tricloruro di ferro è 162,204 g/mol.
