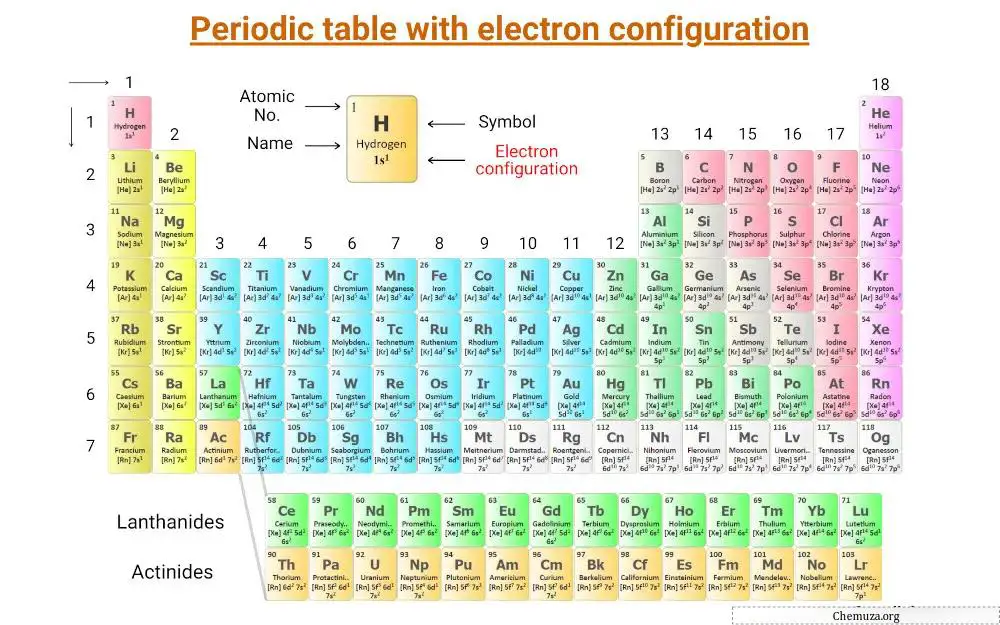
Ini adalah tabel periodik yang menunjukkan konfigurasi elektronik unsur-unsur.
Anda juga dapat mengunduh gambar HD dari sini;
Mari kita jelajahi konfigurasi elektronik unsur-unsur lebih jauh;
Apa yang dimaksud dengan konfigurasi elektronik?
Konfigurasi elektronik mengacu pada susunan elektron dalam atom .
Elektron adalah partikel kecil bermuatan negatif yang mengorbit inti atom yang bermuatan positif .
Konfigurasi elektronik suatu atom menentukan sifat kimia dan fisiknya, seperti reaktivitas, konduktivitas, dan titik lelehnya.
Susunan elektron dalam suatu atom ditentukan oleh tingkat energinya (disebut juga kulit) dan subkulit spesifik di dalam kulit tersebut.
Konfigurasi elektronik biasanya direpresentasikan menggunakan notasi yang menunjukkan jumlah elektron pada setiap kulit dan subkulit, serta mengikuti aturan tertentu berdasarkan prinsip mekanika kuantum.
Apa itu Kerang (n) dan Subkulit (s, p, d, f)?
Kulit: Kulit adalah orbit tempat elektron berputar mengelilingi inti atom.
Setiap cangkang diberi nomor (n), dimulai dengan satu untuk cangkang pertama dan bertambah seiring dengan setiap cangkang tambahan.
Kulit pertama hanya dapat menampung maksimal 2 elektron, sedangkan kulit kedua dapat menampung hingga 8 elektron, dan kulit berikutnya dapat menampung lebih banyak lagi.
Subkulit (atau orbital): Di dalam setiap kulit, terdapat subkulit berbeda, yang diberi label menggunakan huruf seperti s, p, d, dan f.
Subkulit s dapat menampung maksimal 2 elektron, subkulit p dapat menampung hingga 6 elektron, subkulit d dapat menampung hingga 10 elektron, dan subkulit f dapat menampung hingga 14 elektron. [1]
Lapisan dan sublapisan suatu atom menentukan konfigurasi elektroniknya, yang pada gilirannya menentukan sifat kimia dan fisiknya.
Konfigurasi elektron unsur (Daftar)
Berikut adalah daftar konfigurasi elektronik dari 20 unsur pertama tabel periodik.
| Nomor atom | Elemen | Konfigurasi elektronik |
| 1 | Hidrogen (H) | 1 detik 1 |
| 2 | Helium (Dia) | 1s 2 |
| 3 | Litium (Li) | [Itu] 2s 1 |
| 4 | Berilium (Menjadi) | [Dia] 2s 2 |
| 5 | Boron (B) | [Itu] 2s 2 2p 1 |
| 6 | Karbon (C) | [Dia] 2s 2 2p 2 |
| 7 | Nitrogen (N) | [Dia] 2s 2 2p 3 |
| 8 | Oksigen (O) | [Dia] 2s 2 2p 4 |
| 9 | Fluorit (F) | [Itu] 2s 2 2p 5 |
| sepuluh | Neon (Ne) | [Dia] 2s 2 2p 6 |
| 11 | Natrium (Na) | [Lakukan] 3s 1 |
| 12 | magnesium (Mg) | [Lakukan] 3s 2 |
| 13 | Aluminium (Al) | [Lakukan] 3s 2 3p 1 |
| 14 | Silikon (Si) | [Jangan] 3s 2 3p 2 |
| 15 | Fosfor (P) | [Jangan] 3s 2 3p 3 |
| 16 | Belerang (S) | [Lakukan] 3s 2 3p 4 |
| 17 | Klorin (Cl) | [Jangan] 3s 2 3p 5 |
| 18 | Argon (Ar) | [Lakukan] 3s 2 3p 6 |
| 19 | Kalium (K) | [Ar] 4s 1 |
| 20 | Kalsium (Ca) | [Ar] 4s 2 |
