Le trioxyde de chrome, également connu sous le nom d’acide chromique, est un composé inorganique de formule CrO3. C’est l’anhydride acide de l’acide chromique et est parfois commercialisé sous le même nom.
| Nom UICPA | Oxyde de chrome (VI) |
| Formule moléculaire | CrO3 |
| Numero CAS | 1333-82-0 |
| Synonymes | Anhydride chromique, anhydride d’oxyde de chrome, trioxochrome Oxyde de chrome (VI) |
| InChI | InChI=1S/Cr.3O |
Propriétés du trioxyde de chrome
Formule de trioxyde de chrome
La formule de l’anhydride chromique est CrO3. Il se compose d’un atome de chrome lié à trois atomes d’oxygène.
Trioxyde De Chrome Masse molaire
La masse molaire de l’anhydride chromique est calculée en additionnant les masses atomiques de ses éléments constitutifs, qui sont le chrome (Cr) et l’oxygène (O). La masse molaire est d’environ 99,994 g/mol.
Point d’ébullition du trioxyde de chrome
L’anhydride chromique n’a pas de point d’ébullition distinct. Lorsqu’il est chauffé, il se décompose en oxyde de chrome et en oxygène gazeux sans passer par une phase liquide.
Point de fusion du trioxyde de chrome
Le point de fusion de l’anhydride chromique est d’environ 196 °C. A cette température, il passe de l’état solide à l’état liquide.
Densité du trioxyde de chrome g/mL
La densité de l’anhydride chromique est d’environ 2,7 g/mL. Cette valeur représente la masse du composé par unité de volume.
Trioxyde De Chrome Poids moléculaire
Le poids moléculaire de l’anhydride chromique, également appelé masse molaire, est d’environ 99,994 g/mol. C’est la somme des masses atomiques des atomes de chrome et d’oxygène du composé.
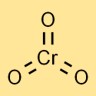
Structure du trioxyde de chrome
L’anhydride chromique a une structure moléculaire dans laquelle un atome de chrome est lié de manière centrale à trois atomes d’oxygène. Il adopte une géométrie tétraédrique, avec l’atome de chrome au centre et les atomes d’oxygène aux coins.
Solubilité du trioxyde de chrome
L’anhydride chromique est hautement soluble dans l’eau. Il se dissout facilement, formant une solution d’acide chromique. La solubilité de l’anhydride chromique dans l’eau lui permet d’être utilisé dans divers procédés et applications chimiques.
| Apparence | Cristaux rouge foncé |
| Gravité spécifique | 2,7 g/ml |
| Couleur | Rouge foncé |
| Odeur | Inodore |
| Masse molaire | 99,994 g/mole |
| Densité | 2,7 g/ml |
| Point de fusion | 196 °C |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans divers solvants tels que l’éthanol, l’éther, etc. |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Acide (en solution) |
Sécurité et dangers du trioxyde de chrome
L’anhydride chromique présente des risques importants pour la sécurité et doit être manipulé avec précaution. C’est une substance hautement corrosive et oxydante, capable de provoquer de graves brûlures de la peau, des yeux et du système respiratoire. L’inhalation ou l’ingestion d’anhydride chromique peut entraîner une détresse respiratoire, des problèmes gastro-intestinaux et même des lésions organiques.
Un équipement de protection individuelle (EPI) approprié doit être porté lorsque vous travaillez avec de l’anhydride chromique, notamment des gants, des lunettes et un respirateur. Il doit être stocké dans un endroit frais et sec, à l’écart des matériaux incompatibles et des sources d’inflammation.
L’élimination de l’anhydride chromique doit être effectuée conformément aux réglementations locales, car il est considéré comme un déchet dangereux. Il ne doit pas être rejeté dans l’environnement.
| Symboles de danger | Corrosif, Comburant |
| Description de la sécurité | Évitez tout contact avec la peau, les yeux et l’inhalation. Utiliser un équipement de protection approprié. |
| Numéros d’identification de l’ONU | ONU 1463 |
| Code SH | 2819.90.90 |
| Classe de danger | 5.1 (Agent comburant) |
| Groupe d’emballage | II |
| Toxicité | Très toxique |
Méthodes de synthèse du trioxyde de chrome
Il existe plusieurs méthodes pour synthétiser l’anhydride chromique.
Une méthode courante implique la réaction entre le dichromate de sodium et l’acide sulfurique . Dans un environnement contrôlé, quelqu’un mélange du bichromate de sodium (Na2Cr2O7) avec de l’acide sulfurique concentré (H2SO4) . La réaction entraîne la formation d’une solution rouge foncé d’anhydride chromique (CrO3) et de sulfate de sodium (Na2SO4) comme sous-produit.
Une autre méthode implique l’oxydation des composés du chrome (III) à l’aide d’agents oxydants puissants tels que le peroxyde d’hydrogène (H2O2) ou l’acide nitrique (HNO3) . Dans ce processus, mélangez le composé de chrome (III) avec l’agent oxydant dans des conditions spécifiques pour convertir le chrome (III) en anhydride chromique.
Préparez de l’anhydride chromique en faisant réagir des composés de chrome métallique ou de chrome (II) avec de puissants agents oxydants tels que le permanganate de potassium (KMnO4) ou le dichromate de potassium (K2Cr2O7). La réaction conduit à la formation d’anhydride chromique.
Il est important de noter que la synthèse de l’anhydride chromique doit être réalisée avec des mesures de sécurité appropriées et dans le respect des réglementations appropriées. Les personnes expérimentées doivent mener le processus de synthèse dans des laboratoires bien équipés pour garantir leur sécurité et minimiser les impacts environnementaux.
Utilisations du trioxyde de chrome
L’anhydride chromique trouve une application comme agent oxydant dans divers processus chimiques, y compris la production de composés organiques.
- Les fabricants l’utilisent pour produire des colorants et des pigments, comme le jaune de chrome et le vert de chrome.
- L’industrie de la galvanoplastie l’utilise pour déposer du chrome sur des surfaces métalliques, offrant ainsi une résistance à la corrosion et une finition attrayante.
- Il est utilisé dans la préparation de catalyseurs au chrome pour les réactions de polymérisation dans la production de plastiques et de matériaux synthétiques.
- Il joue un rôle dans la synthèse de produits pharmaceutiques et d’intermédiaires organiques.
- Les traitements de préservation du bois l’utilisent comme fongicide et insecticide pour se protéger contre la pourriture et les ravageurs.
- Les laboratoires l’utilisent comme réactif pour divers tests et analyses chimiques.
- Son utilisation dans la production de verres et de céramiques spécialisés améliore les couleurs et les propriétés spécifiques.
- L’industrie du tannage l’utilise pour traiter le cuir, contribuant ainsi à la stabilisation et à la teinture des peaux.
- C’est un composant dans la formulation d’agents de nettoyage et de traitements de surface pour les surfaces métalliques.
Il est important de manipuler l’anhydride chromique avec prudence en raison de sa nature toxique et corrosive. Le respect des protocoles de sécurité appropriés garantit la protection des personnes et de l’environnement lors de son utilisation et de son élimination.
Des questions:
Q : Qu’est-ce que le CrO3 ?
R : CrO3 est de l’anhydride chromique, un composé constitué d’un atome de chrome lié à trois atomes d’oxygène.
Q : Le CrO3 est-il un agent oxydant puissant ?
R : Oui, le CrO3 est un agent oxydant puissant couramment utilisé dans les réactions chimiques pour faciliter l’oxydation de divers composés.
Q : Qu’est-ce que le CrO3 fait à l’alcool ?
R : Le CrO3 peut oxyder les alcools et les convertir en composés carbonylés correspondants, tels que les aldéhydes ou les cétones.
Q : Quel produit organique obtiendriez-vous de la réaction du 1-pentanol avec CrO3, H2O et H2SO4 ?
R : La réaction donnerait le produit organique 1-pentanone, qui est une cétone.
Q : Quel est le meilleur choix de réactif pour effectuer la transformation suivante : PCC, HIO4, CrO3, NaOH ?
R : Le meilleur choix de réactif pour cette transformation serait le PCC (chlorochromate de pyridinium).
Q : Le CrO3 est-il amphotère ?
R : Non, le CrO3 n’est pas amphotère. C’est un composé très acide mais incapable de présenter des propriétés basiques.
Q : Comment trouver le nombre d’oxydation du Cr dans le CrO3 ?
R : Le nombre d’oxydation du Cr dans CrO3 est de +6.
Q : Quel est le nom du CrO3 ?
R : Le nom de CrO3 est anhydride chromique.
Q : Que fait le CrO3 aux alcools non anoniques ?
R : CrO3 peut oxyder les alcools non-anoniques, les convertissant en composés carbonylés correspondants, tels que les cétones non-anoniques.
Q : Quelle est la charge du cation de métal de transition dans CrO3 ?
R : Le cation du métal de transition dans CrO3, qui est le chrome, a une charge de +6.
