La triméthylamine (TMA) est un composé à forte odeur de poisson. On le trouve dans le poisson, les produits à base de poisson en décomposition et la sueur humaine. Cela peut provoquer une mauvaise haleine et des odeurs corporelles.
| Nom UICPA | N,N-Diméthylméthanamine |
| Formule moléculaire | C3H9N |
| Numero CAS | 75-50-3 |
| Synonymes | TMA, diméthylamine, méthyldiméthylamine, N,N-diméthylamine, méthyamine tertiaire, méthylamine tertiaire |
| InChI | InChI=1S/C3H9N/c1-4(2)3/h1-3H3 |
Propriétés de la triméthylamine
Formule de triméthylamine
La formule chimique de la triméthylamine est C3H9N, ce qui indique que la molécule contient trois atomes de carbone, neuf atomes d’hydrogène et un atome d’azote. La formule peut être utilisée pour calculer le poids moléculaire et d’autres propriétés de la triméthylamine.
Triméthylamine Masse molaire
La masse molaire du TMA est de 59,11 g/mol. Cette valeur est calculée en additionnant les masses atomiques de tous les atomes présents dans la molécule. La masse molaire est un paramètre important utilisé dans les calculs chimiques, notamment pour la détermination de la stœchiométrie et du nombre de moles d’une substance.
Point d’ébullition de la triméthylamine
Le point d’ébullition du TMA est de -6,9°C ou 19,6°F. Il s’agit d’un point d’ébullition relativement bas, ce qui signifie que le composé est volatil et peut facilement s’évaporer. Le TMA peut être liquéfié en appliquant une pression et il est couramment utilisé sous forme gazeuse dans diverses applications.
Triméthylamine Point de fusion
Le point de fusion du TMA est de -117,3°C ou -179,1°F. Il s’agit d’un point de fusion très bas, ce qui signifie que le composé se trouve généralement à l’état liquide ou gazeux à température ambiante. Il peut être solidifié par refroidissement à des températures inférieures à son point de fusion.
Densité de triméthylamine g/mL
La densité du TMA est de 0,692 g/mL à température ambiante. Cette valeur est utilisée pour déterminer la masse de TMA par unité de volume. La densité du composé est relativement faible par rapport à d’autres liquides, ce qui le rend moins dense que l’eau.
Triméthylamine Poids moléculaire
Le poids moléculaire du TMA est de 59,11 g/mol. Cette valeur est la somme des poids atomiques de tous les atomes de la molécule. Le poids moléculaire est utilisé pour calculer la quantité d’une substance requise pour une réaction ou un processus chimique spécifique.
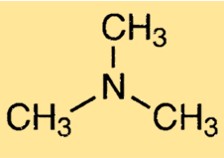
Structure de la triméthylamine
Le TMA a une géométrie moléculaire pyramidale, avec une forme de pyramide trigonale autour de l’atome d’azote. La molécule possède un atome d’azote central lié à trois groupes méthyle. L’atome d’azote possède une paire d’électrons non liants, ce qui contribue à l’odeur caractéristique de la molécule.
Solubilité de la triméthylamine
Le TMA est soluble dans l’eau et les solvants organiques, notamment l’éthanol, l’éther et l’acétone. La solubilité du TMA dans l’eau est de 1,8 g/100 mL à 25°C. Le composé est hautement soluble dans les solvants polaires en raison de sa nature polaire, ce qui le rend utile dans diverses applications industrielles.
| Apparence | Gaz incolore avec une forte odeur de poisson |
| Gravité spécifique | 0,692 à 25°C |
| Couleur | Incolore |
| Odeur | Forte odeur de poisson |
| Masse molaire | 59,11 g/mole |
| Densité | 0,692 g/ml à 25°C |
| Point de fusion | -117,3°C ou -179,1°F |
| Point d’ébullition | -6,9°C ou 19,6°F |
| Point d’éclair | -20°C |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 542 mmHg à 20°C |
| Densité de vapeur | 2.1 à 25°C |
| pKa | 9.79 |
| pH | Alcalin |
Sécurité et dangers de la triméthylamine
Le TMA présente plusieurs risques pour la sécurité, principalement en raison de sa nature hautement inflammable et de sa forte odeur de poisson. Il est classé comme substance dangereuse par plusieurs organismes de réglementation, dont l’Agence américaine de protection de l’environnement (EPA). L’exposition au TMA peut provoquer une irritation de la peau et des yeux, des problèmes respiratoires et des nausées. Il est également toxique lorsqu’il est ingéré ou inhalé en grande quantité. Des précautions appropriées doivent être prises lors de la manipulation du TMA, notamment en portant un équipement de protection approprié et en assurant une ventilation adéquate. En cas d’exposition, des soins médicaux immédiats doivent être recherchés.
| Symboles de danger | Inflammable, Corrosif |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles et des flammes nues. Évitez de respirer des gaz. À utiliser seulement avec une ventilation adéquate. Portez un équipement de protection approprié. |
| Numéros d’identification de l’ONU | UN1083 |
| Code SH | 29211900 |
| Classe de danger | 2.1 – Gaz inflammables |
| Groupe d’emballage | PG I |
| Toxicité | Toxique en cas d’ingestion ou d’inhalation en grande quantité. Provoque une irritation de la peau et des yeux, des problèmes respiratoires et des nausées. |
Méthodes de synthèse de la triméthylamine
Il existe plusieurs méthodes de synthèse du TMA, mais la plus courante est la réaction du formaldéhyde avec le chlorure d’ammonium en présence d’ hydroxyde de calcium . Nous connaissons ce processus sous le nom de réaction d’Eschweiler-Clarke.
Une autre méthode implique la réaction de la diméthylamine avec le formaldéhyde , suivie d’une hydrogénation en présence d’un catalyseur. Nous appelons cette méthode la réaction de Leuckart-Wallach.
La réaction de Frankland produit du TMA lorsque de l’hydroxyde de sodium ou de potassium est présent lors de la réaction de l’ammoniac avec le borate de triméthyle.
On peut produire du TMA en faisant réagir de l’iodure de méthyle avec de l’ammoniac, puis en le réduisant avec de la poussière de zinc. Les chimistes appellent cette méthode la dégradation de Hofmann.
D’autres méthodes moins courantes de synthèse du TMA comprennent la réaction du phosphite de triméthyle avec l’ammoniac, la réaction de l’oxyde de TMA avec l’acide et la réaction du triméthylaluminium avec l’ammoniac .
Dans l’ensemble, la synthèse du TMA nécessite une manipulation minutieuse de produits chimiques réactifs et potentiellement dangereux, ainsi qu’une expertise en chimie organique.
Utilisations de la triméthylamine
Le TMA a plusieurs utilisations dans diverses industries en raison de ses propriétés chimiques uniques, notamment son odeur forte et distincte. Voici quelques-unes des utilisations les plus courantes de la TMA :
- Fabrication de pesticides : Utilisé dans la production de plusieurs pesticides, dont le chlorpyrifos et le diazinon.
- Synthèse organique : Les chimistes organiques utilisent largement le TMA pour synthétiser des sels d’ammonium quaternaire, qui trouvent de nombreuses applications dans diverses industries en raison de leurs propriétés exceptionnelles.
- Traitement des gaz : utilisé pour éliminer les gaz acides, tels que le dioxyde de carbone et le sulfure d’hydrogène, du gaz naturel et des produits pétroliers.
- Industrie pharmaceutique : utilisée dans la production de divers produits pharmaceutiques, notamment l’antidiabétique metformine et l’anesthésique local procaïne.
- Industrie alimentaire : le TMA provoque l’odeur de poisson présente dans certains fruits de mer et ajoute de la saveur à certains produits alimentaires en tant qu’agent aromatisant.
- Recherche en laboratoire : également utilisé dans la recherche en laboratoire, principalement dans l’étude des structures protéiques.
Des questions:
Q : Quelle est la formule chimique de l’acide conjugué de la base triméthylamine (CH3)3N ?
R : La formule chimique de l’acide conjugué du TMA est (CH3)3NH+.
Q : Le pH de la triméthylamine aqueuse 0,050 M est de 11,24. Quel est le Ko de cette base ?
R : Le Kb du TMA peut être calculé en utilisant le pH de sa solution, qui est de 11,24. La valeur Ko est de 1,8 x 10^-5.
Q : Quelle est la concentration initiale de triméthylamine dans l’eau ?
R : La concentration initiale de TMA dans l’eau dépend de la solution spécifique utilisée. Sans informations complémentaires, il est impossible de déterminer la concentration initiale.
Q : La triméthylamine est-elle une base forte ?
R : Le TMA est une base faible, car elle ne se dissocie que partiellement en solution aqueuse.
Q : La triméthylamine est-elle polaire ?
R : Oui, le TMA est une molécule polaire en raison de la présence d’un atome d’azote avec une paire d’électrons libres et des trois groupes méthyle.
Q : La triméthylamine est-elle un acide ou une base ?
R : Le TMA est une base, car il accepte un proton d’un acide pour former son acide conjugué.
Q : La triméthylamine provoque-t-elle des fissures par corrosion sous contrainte dans l’acier au carbone ?
R : Oui, le TMA peut provoquer des fissures par corrosion sous contrainte dans l’acier au carbone dans certaines conditions.
Q : À quoi sert la triméthylamine en HPLC ?
R : Le TMA est utilisé comme additif de phase mobile en HPLC pour améliorer la forme des pics et la séparation des composés basiques.
Q : Quelle est la base la plus forte, la triméthylamine ou la pyridine ?
R : La pyridine est une base plus forte que le TMA car l’atome d’azote fait partie d’un cycle aromatique, qui stabilise l’acide conjugué résultant.
