Le trifluorure d’azote ou NF3 est un puissant gaz à effet de serre utilisé dans l’industrie électronique pour la gravure et le nettoyage au plasma. Il a une longue durée de vie atmosphérique et contribue au changement climatique.
| Nom UICPA | Trifluorure d’azote |
| Formule moléculaire | NF3 |
| Numero CAS | 7783-54-2 |
| Synonymes | Trifluoramine, fluorure d’azote (NF3), fluorure d’azote (1:3), fluorure d’azote (NF3), fluorure d’azote (III), fluorure d’azote, comprimé, UN 2451 |
| InChI | InChI=1S/F3N/c1-4(2)3 |
Trifluorure D’azote Masse molaire
La masse molaire du NF3 est de 71,0 g/mol. Cela signifie qu’une mole de NF3 contient 6,022 x 10^23 molécules.
Point d’ébullition du trifluorure d’azote
Le NF3 a un point d’ébullition de -129,04 °C ou -200,27 °F. Ceci est relativement faible par rapport aux autres gaz, ce qui facilite sa manipulation dans les applications industrielles.
Trifluorure d’azote Point de fusion
Le trifluorure d’azote a un point de fusion de -206,73 °C ou -340,11 °F. Cela signifie qu’à température ambiante, le NF3 est à l’état gazeux.
NF3 Densité g/mL
La densité du NF3 est de 1,88 g/mL à température et pression standard. Cela signifie que le trifluorure d’azote est plus dense que l’air et coulera au sol s’il est rejeté dans l’atmosphère.
Trifluorure D’azote Poids moléculaire
Le poids moléculaire du NF3 est de 71,0 g/mol. C’est la somme des poids atomiques de l’azote et du fluor dans le composé.
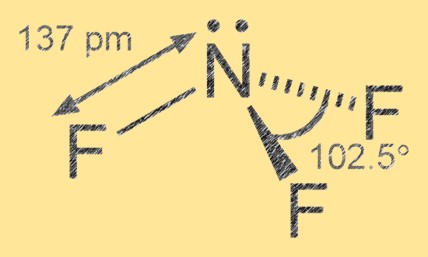
Structure du trifluorure d’azote
Le trifluorure d’azote a une géométrie moléculaire pyramidale trigonale avec l’azote comme atome central et trois atomes de fluor qui l’entourent. La liaison azote-fluor est covalente polaire, les atomes de fluor étant plus électronégatifs que l’azote, conduisant à une charge partielle négative sur les atomes de fluor et une charge partielle positive sur l’atome d’azote.
Formule de trifluorure d’azote
La formule chimique du trifluorure d’azote est NF3, ce qui indique qu’une molécule de NF3 contient un atome d’azote et trois atomes de fluor.
| Apparence | Gaz incolore |
| Gravité spécifique | 2,62 |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 71,0 g/mole |
| Densité | 1,88 g/mL à STP |
| Point de fusion | -206,73 °C ou -340,11 °F |
| Point d’ébullition | -129,04 °C ou -200,27 °F |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 0,41 g/100 mL à 25 °C |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 315 kPa à 20 °C |
| Densité de vapeur | 2,01 (air = 1) |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du trifluorure d’azote
Le trifluorure d’azote (NF3) est généralement considéré comme sûr s’il est manipulé correctement, mais il peut présenter plusieurs dangers s’il est mal manipulé. Il peut provoquer une irritation de la peau et des yeux, et l’inhalation de concentrations élevées peut provoquer une détresse respiratoire. Le gaz NF3 peut déplacer l’oxygène dans les zones mal ventilées, entraînant une asphyxie. C’est également un puissant gaz à effet de serre qui contribue au changement climatique. En cas d’incendie, le NF3 peut libérer du fluorure d’hydrogène gazeux toxique. Il est essentiel de suivre les protocoles de sécurité appropriés, notamment une ventilation adéquate et l’utilisation d’un équipement de protection, lors de la manipulation du NF3 pour éviter ces dangers.
| Symboles de danger | T, C |
| Description de la sécurité | Évitez l’inhalation et le contact avec la peau et les yeux. Utiliser uniquement dans des zones bien ventilées. |
| Numéros d’identification de l’ONU | UN2451 |
| Code SH | 28129090 |
| Classe de danger | 2.3 |
| Groupe d’emballage | II |
| Toxicité | Très toxique |
Méthodes de synthèse du trifluorure d’azote
Plusieurs méthodes existent pour synthétiser le trifluorure d’azote (NF3) :
Une méthode courante implique la réaction de l’ammoniac anhydre (NH3) avec du fluor gazeux (F2) en présence d’un catalyseur tel que le fer, le nickel ou le platine. La réaction produit du NF3 et du fluorure d’hydrogène (HF). Les industries utilisent couramment cette méthode pour la production de NF3.
Une autre méthode implique la décomposition thermique du fluorure d’ammonium (NH4F) à haute température. La réaction produit du NF3 et du gaz ammoniac (NH3). La réaction du NH3 avec le F2 est plus efficace que cette méthode, elle est donc moins couramment utilisée.
Une autre méthode implique la réaction de l’oxyde nitrique (NO) avec du fluor gazeux en présence d’un catalyseur. La réaction produit des gaz NF3 et dioxyde d’azote (NO2).
On peut également synthétiser électrochimiquement le NF3 en faisant passer une décharge électrique à travers un mélange de gaz N2 et F2. Le plasma résultant forme du NF3 et d’autres composés azote-fluor.
Quelle que soit la méthode utilisée, il est crucial de manipuler les réactifs hautement réactifs et potentiellement dangereux avec les précautions de sécurité appropriées. Cependant, les chercheurs doivent contrôler soigneusement le processus de synthèse pour garantir un rendement et une pureté élevés du produit final.
Utilisations du trifluorure d’azote
Le trifluorure d’azote (NF3) a diverses applications industrielles en raison de ses propriétés uniques.
- L’industrie des semi-conducteurs utilise le NF3 comme agent nettoyant pour les plaquettes de silicium. Le NF3 est également utilisé dans la production d’écrans plats, de cellules solaires et de systèmes microélectromécaniques (MEMS).
- La fabrication de composants électroniques utilise le NF3 comme gaz de gravure au plasma. Il présente une grande réactivité et élimine sélectivement certains matériaux tout en en laissant d’autres intacts.
- Les systèmes de refroidissement utilisent également le NF3 comme réfrigérant en raison de son potentiel de réchauffement climatique inférieur à celui des autres réfrigérants, ce qui en fait une option plus respectueuse de l’environnement.
- L’industrie aérospatiale utilise le NF3 comme propulseur en raison de son impulsion spécifique élevée, qui permet une propulsion efficace des engins spatiaux.
Malgré ses nombreuses utilisations, l’impact environnemental du NF3 suscite des inquiétudes. C’est un puissant gaz à effet de serre dont la durée de vie dans l’atmosphère est longue. La production et l’utilisation de NF3 peuvent contribuer au changement climatique si les précautions appropriées ne sont pas prises. C’est pourquoi des efforts sont déployés pour réduire son utilisation et développer des alternatives plus durables.
Des questions:
Q : Le trifluorure d’azote (NF3) est-il polaire ?
R : Oui, NF3 est polaire. Il a une géométrie moléculaire pyramidale trigonale, avec l’atome d’azote au centre et trois atomes de fluor disposés autour de lui. La forme asymétrique de la molécule provoque une répartition inégale de la densité électronique, ce qui donne une molécule polaire.
Q : Quelle est la formule du trifluorure d’azote ?
R : La formule du trifluorure d’azote est NF3, ce qui indique que la molécule est constituée d’un atome d’azote et de trois atomes de fluor.
Q : D’où vient le trifluorure d’azote ?
R : Le NF3 peut être produit par diverses méthodes, notamment la réaction de l’ammoniac anhydre avec du fluor gazeux, la décomposition thermique du fluorure d’ammonium et la synthèse électrochimique. Il est couramment utilisé dans l’industrie des semi-conducteurs comme agent de nettoyage et dans la fabrication de composants électroniques et de propulseurs aérospatiaux.
Q : Structure de Lewis du trifluorure d’azote ?
R : La structure de Lewis pour NF3 est constituée d’un atome d’azote lié à trois atomes de fluor par des liaisons covalentes simples. Il y a également une paire d’électrons non liants sur l’atome d’azote, donnant à la molécule une forme pyramidale trigonale.
Q : Forces intermoléculaires du trifluorure d’azote ?
R : Les forces intermoléculaires de NF3 incluent des interactions dipôle-dipôle, qui résultent de la nature polaire de la molécule. La molécule subit également les forces de dispersion de Londres, qui sont de faibles forces intermoléculaires résultant de fluctuations temporaires de la densité électronique.
Q : Le NF3 est-il polaire ou non polaire ?
R : NF3 est polaire en raison de sa forme asymétrique et de la répartition inégale de la densité électronique. La molécule a un moment dipolaire, indiquant qu’elle a une extrémité positive et négative, ce qui en fait une molécule polaire.
