Le trichlorure de phosphore est un composé chimique composé de phosphore et de trois atomes de chlore. Il est couramment utilisé comme réactif dans les réactions chimiques et comme précurseur de composés organophosphorés.
| Nom UICPA | Trichlorure de phosphore |
| Formule moléculaire | PCl3 |
| Numero CAS | 7719-12-2 |
| Synonymes | Trichlorophosphine, chlorure de phosphore, trichlorure de phosphore, chlorure de phosphore (III) |
| InChI | InChI=1S/Cl3P/c1-4(2)3 |
Propriétés du trichlorure de phosphore
Formule de trichlorure de phosphore
La formule du trichlorure de phosphore est PCl3. Il est constitué d’un atome de phosphore lié à trois atomes de chlore. Ce composé chimique est largement utilisé dans diverses industries et laboratoires pour sa réactivité et sa polyvalence.
Trichlorure De Phosphore Masse molaire
La masse molaire de la trichlorophosphine peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le phosphore a une masse atomique d’environ 31,0 grammes par mole, tandis que le chlore a une masse atomique d’environ 35,5 grammes par mole. Par conséquent, la masse molaire de PCl3 est d’environ 137,3 grammes par mole.
Point d’ébullition du trichlorure de phosphore
La trichlorophosphine a un point d’ébullition d’environ 76,1 degrés Celsius. Cela signifie que lorsqu’il est chauffé, il se transforme d’un liquide en gaz. Le point d’ébullition est une propriété importante à prendre en compte lors de la manipulation et de l’utilisation de la trichlorophosphine dans diverses réactions et processus chimiques.
Trichlorure de phosphore Point de fusion
Le point de fusion de la trichlorophosphine est d’environ -112,7 degrés Celsius. Il subit une transition de phase d’un solide à un liquide à cette température. Le point de fusion est une caractéristique cruciale pour déterminer l’état physique de la trichlorophosphine dans différentes conditions.
Densité du trichlorure de phosphore g/mL
La densité de la trichlorophosphine est d’environ 1,574 grammes par millilitre. La densité représente la masse d’une substance par unité de volume et donne un aperçu de la compacité et de la lourdeur du matériau. La densité de la trichlorophosphine est souvent utilisée dans les calculs et formulations chimiques.
Trichlorure De Phosphore Poids moléculaire
Le poids moléculaire de la trichlorophosphine, calculé en additionnant les poids atomiques de ses constituants, est d’environ 137,3 grammes par mole. Le poids moléculaire est un paramètre précieux pour déterminer la quantité de substance dans les réactions chimiques et formuler des mesures précises.
Structure du trichlorure de phosphore
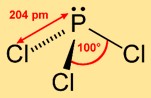
La trichlorophosphine adopte une structure pyramidale trigonale, où l’atome de phosphore occupe le sommet et les trois atomes de chlore forment une base triangulaire. Cet arrangement moléculaire contribue à sa réactivité chimique et influence son comportement dans diverses réactions.
Solubilité du trichlorure de phosphore
La trichlorophosphine est peu soluble dans l’eau, mais elle se dissout facilement dans les solvants organiques tels que le benzène et le tétrachlorure de carbone. Les propriétés de solubilité de la trichlorophosphine sont des considérations essentielles lors de la détermination des solvants appropriés pour son utilisation dans différents processus et applications chimiques.
| Apparence | Liquide incolore ou jaune pâle |
| Gravité spécifique | 1,574 g/mL |
| Couleur | Incolore |
| Odeur | Âcre |
| Masse molaire | 137,3 g/mole |
| Densité | 1,574 g/mL |
| Point de fusion | -112,7 °C |
| Point d’ébullition | 76,1 °C |
| Point d’éclair | Sans objet (Ininflammable) |
| Solubilité dans l’eau | Réagit avec l’eau |
| Solubilité | Soluble dans les solvants organiques tels que le benzène et le tétrachlorure de carbone |
| La pression de vapeur | 105 mmHg à 25 °C |
| Densité de vapeur | 4,83 (Air = 1) |
| pKa | N’est pas applicable |
| pH | Acide (pH < 7) |
Sécurité et dangers du trichlorure de phosphore
La trichlorophosphine présente plusieurs risques pour la sécurité et doit être manipulée avec prudence. Il est très corrosif pour la peau, les yeux et le système respiratoire. Un contact direct peut provoquer de graves brûlures et des lésions oculaires. L’inhalation de ses vapeurs peut entraîner une irritation respiratoire et des lésions pulmonaires. De plus, la trichlorophosphine réagit violemment avec l’eau, libérant des vapeurs toxiques d’acide chlorhydrique. Il est inflammable dans certaines conditions et le contact avec des agents oxydants peut provoquer des incendies ou des explosions. Un équipement de protection individuelle adéquat, tel que des gants, des lunettes et un respirateur, doit être utilisé lorsque vous travaillez avec ce produit chimique. Une ventilation adéquate et un stockage à l’écart des substances incompatibles sont essentiels pour minimiser les risques.
| Symboles de danger | Corrosif, Toxique |
| Description de la sécurité | – Provoque de graves brûlures de la peau et des lésions oculaires – Nocif en cas d’ingestion, d’inhalation ou d’absorption – Réagit violemment avec l’eau en dégageant des fumées toxiques – Inflammable sous certaines conditions |
| Identifiants des Nations Unies | UN1809 |
| Code SH | 2812.10.00 |
| Classe de danger | 8 (Corrosif), 6.1 (Toxique) |
| Groupe d’emballage | II |
| Toxicité | Très toxique |
Méthodes de synthèse du trichlorure de phosphore
Diverses méthodes synthétisent la trichlorophosphine. Une approche courante consiste à chauffer le phosphore avec un excès de chlore gazeux, conduisant à la formation de trichlorophosphine.
Une autre méthode consiste à chauffer du pentachlorure de phosphore (PCl5) avec de la trichlorophosphine (PCl3) pour produire de la trichlorophosphine.
La réaction entre l’oxyde de phosphore (P2O5) et l’acide chlorhydrique (HCl) combine les deux substances, généralement avec un condenseur à reflux, pour faciliter la synthèse de la trichlorophosphine.
De plus, le chauffage du tribromure de phosphore (PBr3) avec de la trichlorophosphine entraîne la production de trichlorophosphine.
Il est important de noter que la synthèse de la trichlorophosphine doit être effectuée avec les précautions de sécurité appropriées, car elle implique la manipulation de substances réactives et dangereuses. Assurer la sécurité pendant le processus de synthèse en employant un équipement de protection approprié et en maintenant des conditions de laboratoire bien ventilées.
Dans l’ensemble, ces différentes méthodes de synthèse offrent différentes approches pour obtenir de la trichlorophosphine, offrant ainsi une flexibilité dans sa production pour un large éventail d’applications industrielles et de recherche.
Utilisations du trichlorure de phosphore
La trichlorophosphine est largement utilisée dans plusieurs applications en raison de sa nature polyvalente et de sa réactivité. Voici quelques utilisations clés :
- Réactif chimique : Il sert de réactif important dans la synthèse organique, notamment dans la production de composés organophosphorés. Il participe à des réactions comme la réaction de Vilsmeier-Haack et la réaction de Pudovik.
- Catalyseur : La trichlorophosphine agit comme un catalyseur dans diverses réactions chimiques, notamment la synthèse de produits pharmaceutiques, de colorants et de pesticides.
- Source de phosphore : Il sert de source de phosphore dans la production de produits chimiques à base de phosphore comme l’acide phosphoreux et l’oxychlorure de phosphore.
- Ignifuge : Les fabricants ajoutent de la trichlorophosphine comme ignifuge aux polymères, permettant de réduire l’inflammabilité et d’améliorer la sécurité incendie des matériaux.
- Intermédiaire chimique : Divers produits chimiques, notamment des produits pharmaceutiques, des herbicides, des insecticides et des plastifiants, sont produits en utilisant la trichlorophosphine comme intermédiaire crucial.
- Réactif de laboratoire : Les laboratoires utilisent largement la trichlorophosphine comme réactif polyvalent pour les réactions chimiques, notamment la formation de chlorures d’acyle et la conversion d’alcools en chlorures d’alkyle.
- Traitement de l’eau : Les fortes propriétés oxydantes et chlorantes de la trichlorophosphine en font un composant précieux dans les processus de traitement de l’eau, éliminant efficacement les impuretés et les contaminants.
- Produits pharmaceutiques : la trichlorophosphine joue un rôle dans la synthèse de composés pharmaceutiques, notamment des médicaments destinés au traitement du cancer, de l’inflammation et des troubles neurologiques.
- Applications agricoles : Il trouve des applications en agriculture en tant que composant de certains pesticides et herbicides, contribuant ainsi à la protection des cultures et au contrôle des mauvaises herbes.
- Fabrication de plastique : les fabricants utilisent la trichlorophosphine dans la production de plastiques et d’additifs polymères pour améliorer les propriétés des matériaux et les rendre ignifuges.
Ces diverses applications mettent en évidence l’importance de la trichlorophosphine dans diverses industries, recherches et applications quotidiennes.
Des questions:
Q : Le trichlorure de phosphore est-il une base ou un acide ?
R : La trichlorophosphine est un acide.
Q : Combien d’atomes de chlore y a-t-il dans une molécule de trichlorure de phosphore, PCl3 ?
R : Il y a trois atomes de chlore dans une molécule de trichlorophosphine.
Q : Quel est le pourcentage de rendement d’une réaction dans laquelle 200 g de trichlorure de phosphore réagissent ?
R : Le pourcentage de rendement ne peut être déterminé sans informations sur la quantité de produit obtenu.
Q : Combien de moles y a-t-il dans 15 grammes de trichlorure de phosphore ?
R : Il y a environ 0,116 mole de trichlorophosphine dans 15 grammes.
Q : Quelle formule représente le composé moléculaire binaire trichlorure de phosphore ?
R : La formule PCl3 représente la trichlorophosphine.
Q : Quelle est la formule du trichlorure de phosphore ?
R : La formule du trichlorure de phosphore est PCl3.
Q : Le trichlorure de phosphore est-il ionique ou covalent ?
R : La trichlorophosphine est un composé covalent.
Q : Combien d’atomes de chlore y a-t-il dans une molécule de trichlorure de phosphore, PCl3 ?
R : Il y a trois atomes de chlore dans une molécule de trichlorophosphine.
Q : Structure de Lewis de la trichlorophosphine ?
R : La structure de Lewis de la trichlorophosphine comporte un atome de phosphore central lié à trois atomes de chlore, avec des paires isolées sur l’atome de phosphore.
Q : Phosphore (P4) (s) + Chlore (g) → Trichlorophosphine (l) ?
R : L’équation équilibrée représente la réaction entre le phosphore solide (P4) et le chlore gazeux (Cl2) pour former du PCl3 liquide.
Q : Quelle est la forme du trichlorure de phosphore ?
R : La trichlorophosphine a une forme pyramidale trigonale en raison de la présence d’une paire d’électrons libres sur l’atome de phosphore.
Q : Le trichlorure de phosphore est-il un composé ionique ?
R : Non, la trichlorophosphine n’est pas un composé ionique ; c’est un composé covalent.
Q : Le trichlorure de phosphore a-t-il des plans de réflexion ?
R : Non, la trichlorophosphine n’a pas de plans de réflexion.
