Le tribromure de phosphore (PBr3) est un composé constitué d’un atome de phosphore et de trois atomes de brome. Il est utilisé comme réactif dans diverses réactions chimiques, notamment dans la synthèse de composés organiques.
| Nom UICPA | Tribromure de phosphore |
| Formule moléculaire | PBr3 |
| Numero CAS | 7789-60-8 |
| Synonymes | Bromure de phosphore (III), bromure de bromophosphore, tribromophosphine |
| InChI | InChI=1S/Br3P/c1-4(2)3 |
Propriétés du tribromure de phosphore
Formule de tribromure de phosphore
La formule du bromure de phosphore (III) est PBr3. Il se compose d’un atome de phosphore et de trois atomes de brome. Ce composé se forme lorsque le phosphore réagit avec le brome. La formule représente avec précision la composition du composé.
Tribromure De Phosphore Masse molaire
La masse molaire du bromure de phosphore (III) peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le phosphore a une masse atomique d’environ 31,0 grammes par mole, tandis que le brome a une masse atomique d’environ 79,9 grammes par mole. En ajoutant trois fois la masse atomique du brome à la masse atomique du phosphore, nous obtenons la masse molaire du bromure de phosphore (III), soit environ 270,7 grammes par mole.
Point d’ébullition du tribromure de phosphore
Le bromure de phosphore (III) a un point d’ébullition d’environ 173 degrés Celsius. Cela signifie qu’à des températures supérieures à ce point, le composé subira un changement de phase d’un liquide à un gaz. Le point d’ébullition est une caractéristique importante qui permet de déterminer les conditions dans lesquelles le composé peut être utilisé ou purifié.
Tribromure De Phosphore Point de fusion
Le point de fusion du bromure de phosphore (III) est d’environ -41 degrés Celsius. Cette température indique le point auquel le composé passe de l’état solide à l’état liquide. Connaître le point de fusion est crucial pour manipuler et manipuler le composé dans divers processus chimiques.
Densité du tribromure de phosphore g/mL
La densité du bromure de phosphore (III) est d’environ 2,85 grammes par millilitre (g/mL). La densité mesure la masse d’une substance par unité de volume. Avec sa densité relativement élevée, le bromure de phosphore (III) est plus dense que de nombreux autres liquides courants, ce qui indique qu’il est relativement lourd pour son volume.
Tribromure De Phosphore Poids moléculaire
Le poids moléculaire du bromure de phosphore (III) est d’environ 270,7 grammes par mole. Cette valeur est calculée en additionnant les masses atomiques de tous les atomes du composé, sur la base de la formule moléculaire PBr3. Le poids moléculaire est utile dans divers calculs, notamment pour déterminer la quantité de substance présente dans une masse donnée.
Structure du tribromure de phosphore
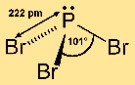
Le bromure de phosphore (III) a une structure moléculaire pyramidale. Il se compose d’un atome central de phosphore lié à trois atomes de brome. Cet agencement donne à la molécule une forme pyramidale trigonale, avec l’atome de phosphore au sommet et les atomes de brome à la base. Cette structure est importante pour comprendre la réactivité et le comportement du composé dans les réactions chimiques.
Solubilité du tribromure de phosphore
Le bromure de phosphore (III) est peu soluble dans l’eau. Il réagit avec l’eau pour produire de l’acide bromhydrique et de l’acide phosphoreux. Cependant, il est soluble dans les solvants organiques tels que le benzène et le tétrachlorure de carbone. La solubilité détermine la mesure dans laquelle un composé peut se dissoudre dans un solvant particulier, ce qui a des implications sur ses applications et sa manipulation dans divers processus.
| Apparence | Liquide incolore |
| Gravité spécifique | 2,85 g/ml |
| Couleur | Incolore |
| Odeur | Âcre |
| Masse molaire | 270,7 g/mole |
| Densité | 2,85 g/ml |
| Point de fusion | -41 °C |
| Point d’ébullition | 173 °C |
| Point d’éclair | Pas disponible |
| Solubilité dans l’eau | Réagit |
| Solubilité | Soluble dans les solvants organiques tels que le benzène et le tétrachlorure de carbone |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Pas disponible |
Sécurité et dangers du tribromure de phosphore
Le bromure de phosphore (III) présente certains risques pour la sécurité et doit être manipulé avec prudence. Il est corrosif et peut provoquer de graves brûlures au contact de la peau, des yeux ou du système respiratoire. L’inhalation ou l’ingestion directe de ce composé peut entraîner une irritation respiratoire et gastro-intestinale. Il réagit violemment avec l’eau, libérant des fumées toxiques et générant de la chaleur. Une ventilation adéquate et des équipements de protection individuelle, tels que des gants et des lunettes, doivent être utilisés lorsque vous travaillez avec du bromure de phosphore (III). De plus, il doit être conservé à l’écart des substances incompatibles pour éviter des réactions potentielles. Dans l’ensemble, le strict respect des protocoles de sécurité et la connaissance des dangers associés à ce composé sont essentiels pour une manipulation en toute sécurité.
| Symboles de danger | Corrosif |
| Description de la sécurité | Manipulez avec prudence. Évitez tout contact avec la peau, les yeux et le système respiratoire. Utilisez une ventilation adéquate et un équipement de protection individuelle. Conserver à l’écart des substances incompatibles. |
| Numéros d’identification de l’ONU | UN1805 |
| Code SH | 2812.90.90 |
| Classe de danger | 8 (Corrosif) |
| Groupe d’emballage | II |
| Toxicité | Toxique par inhalation et ingestion. Peut provoquer de graves brûlures et irritations. |
Méthodes de synthèse du tribromure de phosphore
Dans une méthode courante de synthèse du bromure de phosphore (III), le récipient de réaction combine directement le phosphore élémentaire et le brome, généralement dans des conditions contrôlées. La réaction se déroule avec le transfert d’atomes de brome vers les atomes de phosphore, entraînant la formation de bromure de phosphore (III).
Une autre méthode implique la réaction entre le trichlorure de phosphore (PCl3) et le bromure d’hydrogène (HBr) . Dans cette approche, le trichlorure de phosphore réagit d’abord avec du bromure d’hydrogène gazeux, produisant du bromure de phosphore (III) et du chlorure d’hydrogène gazeux comme sous-produits. Cette méthode offre une voie alternative pour obtenir du bromure de phosphore (III).
Dans la « méthode au phosphore rouge », on combine le phosphore rouge avec du brome ou de l’acide bromhydrique et on effectue la réaction dans des conditions contrôlées. Le phosphore rouge sert de source de phosphore, réagissant avec le brome ou l’acide bromhydrique pour produire du bromure de phosphore (III).
Ces méthodes de synthèse ouvrent des voies de production de bromure de phosphore (III), chacune ayant ses propres avantages et considérations. Le choix de la méthode dépend de facteurs tels que la disponibilité des réactifs, le rendement souhaité et les conditions de réaction spécifiques. Il est important de réaliser ces synthèses dans un laboratoire bien équipé, en respectant les protocoles de sécurité et les procédures de manipulation des produits chimiques impliqués.
Utilisations du tribromure de phosphore
Le bromure de phosphore (III) trouve diverses applications en raison de sa réactivité et de ses propriétés uniques. Voici quelques-unes de ses utilisations :
- Synthèse organique : les chimistes utilisent largement le bromure de phosphore (III) comme réactif en synthèse organique pour convertir les alcools en bromures d’alkyle, une étape clé dans la synthèse de nombreux composés organiques.
- Industrie pharmaceutique : La production de produits pharmaceutiques dépend fortement du bromure de phosphore (III) pour synthétiser divers intermédiaires médicamenteux et ingrédients pharmaceutiques actifs (API).
- Retardateurs de flamme : les fabricants utilisent du bromure de phosphore (III) dans la production de retardateurs de flamme, améliorant les propriétés de résistance au feu de certains polymères destinés à une utilisation dans des industries comme l’électronique et le textile.
- Fabrication de produits chimiques : le bromure de phosphore (III) sert d’intermédiaire précieux dans la production d’autres produits chimiques, notamment des composés du phosphore tels que les dérivés de l’acide phosphorique, les phosphonates et les phosphates.
- Herbicides et pesticides : La synthèse d’ingrédients actifs spécifiques utilisés dans les herbicides et les pesticides utilise le bromure de phosphore (III) pour lutter efficacement contre les mauvaises herbes, les ravageurs et les maladies en agriculture.
- Recherche en laboratoire : en laboratoire, les chercheurs utilisent couramment le bromure de phosphore (III) comme réactif dans diverses expériences et réactions, en particulier celles impliquant la bromation et la manipulation de composés organiques.
- Analyse chimique : le bromure de phosphore (III) trouve une application dans les techniques d’analyse chimique, permettant de déterminer la présence de groupes fonctionnels spécifiques dans les composés organiques par le biais de réactions de substitution du brome.
Ces diverses utilisations mettent en évidence l’importance du bromure de phosphore (III) dans la synthèse organique, les produits pharmaceutiques, les retardateurs de flamme, la fabrication de produits chimiques, l’agriculture, la recherche en laboratoire et l’analyse chimique. Sa réactivité et sa polyvalence en font un composé précieux dans diverses industries et disciplines scientifiques.
Des questions:
Q : Pourquoi AlBr3 est-il appelé bromure d’aluminium alors que PBr3 est tribromure de phosphore ?
R : La convention de dénomination des composés impliquant des métaux utilise généralement le nom élémentaire du métal suivi du nom du non-métal, tandis que dans le cas du PBr3, le phosphore est spécifié pour indiquer la présence d’un atome de phosphore central.
Q : Quel mot ou quelle expression de deux mots décrit le mieux la forme du tribromure de phosphore ?
R : La forme du bromure de phosphore (III) est mieux décrite comme pyramidale trigonale.
Q : Combien d’électrons de valence y a-t-il dans la molécule de tribromure de phosphore, PBr3 ?
R : Le bromure de phosphore (III) (PBr3) possède 26 électrons de valence.
Q : Le tribromure de phosphore est-il ionique ou covalent ?
R : Le bromure de phosphore (III) (PBr3) est un composé covalent.
Q : Quelle est la formule chimique du tribromure de phosphore ?
R : La formule chimique du bromure de phosphore (III) est PBr3.
Q : Structure de Lewis pour le tribromure de phosphore, PBr3 ?
R : La structure de Lewis du PBr3 montre le phosphore comme atome central entouré de trois atomes de brome liés, chacun relié par une simple liaison.
Q : Le PBr3 est-il une inversion ?
R : Non, le bromure de phosphore (III) (PBr3) ne présente pas d’inversion.
Q : Le PBr3 est-il un électrophile ?
R : Oui, le PBr3 peut agir comme électrophile dans certaines réactions, où il accepte des électrons.
Q : Quelle est la géométrie moléculaire du PBr3 ?
R : La géométrie moléculaire du PBr3 est pyramidale trigonale.
Q : Le PBr3 est-il polaire ou non polaire ?
R : PBr3 est une molécule polaire en raison de la répartition inégale de la densité électronique causée par la présence de liaisons polaires P-Br.
Q : Combien de moles de PBr3 contiennent 3,68 × 10^25 atomes de brome ?
R : Pour déterminer le nombre de moles, nous avons besoin de la masse molaire de PBr3, puis nous divisons le nombre donné d’atomes de brome par le nombre d’Avogadro.
Q : Quel est le nom correct du PBr3 ?
R : Le nom correct du PBr3 est bromure de phosphore (III).
Q : Le PBr3 est-il polaire ?
R : Oui, le PBr3 est une molécule polaire en raison de la présence de liaisons polaires et d’une répartition inégale de la densité électronique.
