Sülfüril klorür (SO2Cl2), kükürt dioksit ve klorun birleşiminden oluşan bir bileşiktir. Kimyasal reaksiyonlarda reaktif olarak ve zararlıları kontrol etmek için fumigant olarak kullanılır.
| IUPAC Adı | Sülfüril klorür |
| Moleküler formül | SO2Cl2 |
| CAS numarası | 7791-25-5 |
| Eş anlamlı | Sülfürik diklorür, Sülfür oksiklorür, Sülfür diklorür oksit |
| InChI | InChI=1S/Cl2O2S/c1-5(2)6(3)4 |
Sülfüril klorürün özellikleri
Sülfüril Klorür Formülü
Sülfürik diklorürün kimyasal formülü SO2Cl2’dir. Bir kükürt atomu, iki oksijen atomu ve iki klor atomunun birleşiminden türetilir. Bu formül, bir sülfürik diklorür molekülündeki atomların bileşimini ve düzenini temsil eder.
Sülfüril Klorür Molar Kütlesi
Sülfürik diklorürün molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Sülfürik diklorürün molar kütlesi mol başına yaklaşık 134,97 gramdır. Bu değer, kimyasal reaksiyonların ve stokiyometrinin çeşitli hesaplamaları için önemlidir.
Sülfüril klorürün kaynama noktası
Sülfürik diklorürün kaynama noktası yaklaşık 69 santigrat derecedir. Sıcaklık bu noktanın üzerine çıktığında, sülfürik diklorür faz değişimine uğrayarak sıvıdan gaza dönüşür. Kaynama noktası, sülfürik diklorürün kullanılabileceği veya işlenebileceği koşulların belirlenmesinde çok önemli bir parametredir.
Sülfüril Klorürün Erime Noktası
Sülfürik diklorürün erime noktası yaklaşık -54 santigrat derecedir. Bu noktanın altındaki sıcaklıklarda sülfürik diklorür katı halden sıvı hale geçer. Erime noktası, sülfürik diklorürün depolanması ve taşınması için önemlidir çünkü hangi koşullar altında katılaştığını veya sıvılaştığını gösterir.
Sülfüril klorürün yoğunluğu g/mL
Sülfürik diklorürün yoğunluğu mililitre başına yaklaşık 1,638 gramdır (g/mL). Yoğunluk, bir maddenin birim hacim başına kütlesini temsil eder ve fiziksel davranışının belirlenmesine yardımcı olur. Sülfürik diklorürün yoğunluğu, kaldırma kuvvetinin, çözünürlüğünün ve diğer maddelerle uyumluluğunun anlaşılması açısından önemlidir.
Sülfüril Klorür Molekül Ağırlığı
Sülfürik diklorürün moleküler ağırlığı yaklaşık 134,97 atomik kütle birimidir (u). Bir sülfürik diklorür molekülünü oluşturan atomların atomik kütlelerinin toplamıdır. Molekül ağırlığı, çeşitli kimyasal hesaplamalar ve belirli bir numunedeki madde miktarının belirlenmesi için önemli bilgiler sağlar.
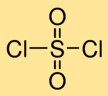
Sülfüril klorürün yapısı
Sülfürik diklorür, bir kükürt atomunun iki oksijen atomuna çift bağlandığı ve iki klor atomuna tek bağlandığı moleküler bir yapıya sahiptir. Bu düzenleme, sülfürik diklorüre karakteristik yapısını veren, oksijen ve klor atomları ile çevrelenmiş merkezi bir sülfür atomu oluşturur.
Sülfüril klorürün çözünürlüğü
Sülfürik diklorür suda çok az çözünür. Su ile reaksiyona girerek hidroklorik asit ve sülfürik asit üretir, bu da onu hidrolitik olarak reaktif hale getirir. Bununla birlikte, sülfürik diklorür, klorlu hidrokarbonlar ve aromatik bileşikler gibi organik çözücülerde bir miktar çözünürlük sergileyerek onları belirli uygulamalar için uygun hale getirir.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 1.638 g/mL |
| Renk | Yok |
| Koku | Keskin, boğucu |
| Molar kütle | 134,97 gr/mol |
| Yoğunluk | 1.638 g/mL |
| Füzyon noktası | -54°C |
| Kaynama noktası | 69°C |
| Flaş noktası | Yok |
| sudaki çözünürlük | Şiddetli tepki veriyor |
| çözünürlük | Klorlu hidrokarbonlar ve aromatik bileşikler gibi organik çözücülerde çözünür |
| Buhar basıncı | 43,6 mmHg (25°C’de) |
| Buhar yoğunluğu | 4,43 (hava = 1) |
| pKa | Yok |
| pH | Yok |
Sülfüril Klorürün Güvenliği ve Tehlikeleri
Sülfürik diklorür çeşitli güvenlik tehlikeleri oluşturur ve kullanılırken önlemler alınmalıdır. Temas halinde ciltte, gözlerde ve solunum yollarında ciddi yanıklara neden olabilecek aşındırıcı bir maddedir. Buharlarının doğrudan solunması solunum yolu tahrişine ve akciğer hasarına neden olabilir. Suyla şiddetli reaksiyona girerek zehirli gazlar çıkarır ve patlama riski oluşturur. Bu nedenle, sülfürik diklorürün iyi havalandırılmış bir alanda işlenmesi ve eldiven, gözlük ve solunum koruması gibi uygun koruyucu ekipmanların kullanılması önemlidir. Dökülmeler uygun prosedürler kullanılarak derhal temizlenmeli ve uyumsuz malzemelerden uzakta, serin ve kuru bir alanda saklanmalıdır.
| Tehlike sembolleri | Aşındırıcı (C), Oksitleyici (O) |
| Güvenlik Açıklaması | Ciddi cilt yanıklarına ve göz hasarına neden olur. Suyla şiddetli reaksiyona girer. |
| BM kimlik numaraları | UN 1834 (Sülfürik diklorür) |
| HS kodu | 28121000 |
| Tehlike sınıfı | 8 (Aşındırıcı maddeler) |
| Paketleme grubu | II (Orta tehlike) |
| Toksisite | Çok zehirli; Yutulması, solunması veya deri yoluyla emilmesi halinde zararlıdır. |
Sülfüril klorür sentezi için yöntemler
İnsanlar genellikle sülfürik diklorürü sentezlemek için birkaç yöntem kullanırlar.
Yöntemlerden biri kükürt dioksit (SO2) ile klor gazı (Cl2) arasındaki reaksiyonu içerir. Aktif karbon veya alüminyum klorür gibi bir katalizörün varlığında gazlar, sülfürik diklorürü (SO2Cl2) oluşturmak üzere reaksiyona girer. Bu reaksiyon genellikle 100 ila 200°C civarındaki yüksek sıcaklıklarda meydana gelir.
Sülfürik diklorürü sentezlemenin başka bir yöntemi, kükürt trioksitin (SO3) hidrojen klorür (HCl) ile reaksiyonunu içerir. Kontrollü koşullar altında bu iki bileşik birleşerek sülfürik diklorür üretir. Bu reaksiyon ekzotermiktir ve genellikle gaz fazında meydana gelir.
Tiyonil klorür işlemi, sülfürik asidin (H2SO4) fosfor pentaklorür (PCl5) ile oda sıcaklığında reaksiyonuyla sülfürik diklorür üretir. Bu reaksiyon, sülfürik diklorürün yanı sıra fosforik asit (H3PO4) ve hidrojen klorür (HCl) gibi yan ürünleri de üretir. Endüstriyel ortamlar genellikle bu yöntemi kullanır.
Bu sentez yöntemlerinin, reaktiflerin dikkatli bir şekilde kullanılmasını ve ilgili maddelerin reaktivitesi ve tehlikeli doğasından dolayı güvenlik önlemlerinin dikkate alınmasını gerektirdiğini unutmamak önemlidir.
Ek olarak kimyagerler, reaksiyon koşullarını kontrol etmek ve sülfürik diklorürün başarılı sentezini sağlamak için sıklıkla yoğunlaştırıcılar ve geri akış sistemleri gibi uygun ekipmanları kullanırlar.
Sülfüril Klorürün Kullanım Alanları
Sülfürik diklorür (SO2Cl2), benzersiz özelliklerinden dolayı farklı endüstrilerde çeşitli uygulamalar bulur. Sülfürik diklorürün bazı önemli kullanım alanları şunlardır:
- Kimyasal Reaktif: Organik sentez tipik olarak çok yönlü bir kimyasal reaktif olarak sülfürik diklorürü kullanır; burada klorlama, sülfonasyon ve esterifikasyon dahil olmak üzere çeşitli reaksiyonlara aktif olarak katılır ve organik bileşiklere klor, kükürt veya asit işlevselliklerinin dahil edilmesine izin verir.
- Pestisit ve Fümigant: Sülfürik diklorür, depolanan tahıl, un değirmenleri ve gıda işleme tesislerindeki zararlıları kontrol etmek için güçlü bir fümigant görevi görür ve güçlü biyosidal özellikleri nedeniyle depolanan tarım ürünlerine zarar verebilecek böcekleri, larvaları ve zararlıları aktif olarak ortadan kaldırır.
- Polimerizasyon: Vinil klorür gibi spesifik monomerlerin polimerizasyonunda, sülfürik diklorür aktif bir katalizör veya başlatıcı olarak görev yaparak inşaat, otomobil ve elektrik endüstrilerindeki uygulamalarda yaygın olarak kullanılan bir termoplastik polimer olan polivinil klorürün (PVC) üretimini kolaylaştırır.
- Farmasötikler: Sülfürik diklorür, farmasötik bileşiklerin, özellikle de çeşitli enfeksiyonları tedavi etmek için kullanılan temel antibiyotikler ve terapötik ajanlar olan sülfonamidlerin sentezinde aktif olarak önemli bir rol oynar.
- Boya imalatı: Sülfürik diklorür, özellikle kükürt veya klor içeren boyaların üretiminde aktif olarak yer alır. İstenilen fonksiyonel grupları aktif olarak tanıtır ve renk haslığını ve boya stabilitesini artırır.
- Kimyasal ara maddeler: Sülfürik diklorür, deterjan üretimi, plastik imalatı ve farmasötikler gibi birçok endüstride uygulama alanı bulan kükürt dioksit, sülfürik asit ve sülfonil klorürler dahil olmak üzere diğer kimyasalların sentezinde aktif bir ara madde olarak hizmet eder.
- Su Arıtma: Suyun arıtılması ve dezenfeksiyonu için sülfürik diklorür, su kaynaklarında bulunan zararlı bakterileri, virüsleri ve diğer mikroorganizmaları aktif olarak nötralize eder ve ortadan kaldırır.
- Laboratuvar uygulamaları: Çeşitli laboratuvar prosedürlerinde, örneğin birincil ve ikincil aminlerin tespiti ve belirlenmesi için aktif olarak sülfürik diklorür kullanılır. Kararlı sülfonamidler oluşturmak için aminlerle aktif olarak reaksiyona girerek bunların analizini ve karakterizasyonunu kolaylaştırır.
Sorular:
S: 13,5 g sülfüril klorürdeki SO2Cl2’nin toplam gram molekülü sayısı nedir?
C: 13,5 g sülfüril klorürdeki SO2Cl2’nin gram moleküllerinin toplam sayısı, verilen kütlenin SO2Cl2’nin molar kütlesine bölünmesiyle hesaplanabilir.
S: SO2Cl2 polar mı yoksa polar değil mi?
C: SO2Cl2, polar bağların varlığı ve asimetrik moleküler geometri nedeniyle polar bir moleküldür.
S: SO2Cl2 basıncı ne zaman düşecek?
C: SO2Cl2’nin basınç düşüşü sıcaklık, hacim ve reaksiyon koşulları gibi çeşitli faktörlere bağlıdır. Bu sadece zamana göre belirlenemez.
S: Bu karışımdaki SO2Cl2’nin kısmi basıncı nedir?
C: Bir karışımdaki SO2Cl2’nin kısmi basıncı, sıcaklığa, hacme ve mol fraksiyonuna veya SO2Cl2 konsantrasyonuna bağlı olarak ideal gaz kanunu kullanılarak belirlenebilir.
S: SO2Cl2 molekülleri arasında ne tür moleküller arası kuvvetler bekleniyor?
C: SO2Cl2 molekülleri arasında beklenen moleküller arası kuvvetler, dipol-dipol etkileşimlerini ve London dağılım kuvvetlerini içerir.
S: SO2Cl2’nin kısmi basıncı hangi noktada başlangıç değerinin onda birine düşecek?
C: SO2Cl2’nin kısmi basıncının başlangıç değerinin onda birine düşmesi için gereken süre, sistemin özel koşullarına ve ilgili kimyasal reaksiyonun hızına bağlıdır.
S: SO2Cl2’nin molar kütlesi nedir?
C: SO2Cl2’nin molar kütlesi mol başına yaklaşık 134,97 gramdır.
S: SO2Cl2’nin moleküler geometrisi nedir?
C: SO2Cl2’nin moleküler geometrisi kavisli veya V şeklindedir; merkezde iki oksijen atomuna ve iki klor atomuna bağlı bir kükürt atomu vardır.
S: SO2Cl2’nin Lewis yapısı nedir?
C: SO2Cl2’nin Lewis yapısı, bir oksijen atomuna çift bağlı bir kükürt atomundan ve başka bir oksijen atomuna tek bir bağdan ve kükürt atomuna bağlı iki klor atomundan oluşur.
