Sülfürik asit (H2SO4) veya vitriol yağı, gübre üretimi, petrol rafinasyonu ve metal işleme gibi çeşitli endüstriyel işlemlerde yaygın olarak kullanılan oldukça aşındırıcı ve güçlü bir mineral asittir. Aynı zamanda güçlü bir dehidrasyon ajanıdır.
| IUPAC Adı | Sülfürik asit |
| Moleküler formül | H2SO4 |
| CAS numarası | 7664-93-9 |
| Eş anlamlı | Vitriol yağı, sülfürik asit anhidrit, bisülfürik asit |
| InChI | InChI=1S/H2O4S/c2-1(3)4/h(H2,2,3,4)/p-1 |
Sülfürik asidin özellikleri
Sülfürik Asit Formülü
Sülfürik asidin kimyasal formülü, iki hidrojen atomunu, bir kükürt atomunu ve dört oksijen atomunu temsil eden H2SO4’tür. Bu formül, sülfürik asit molekülünün bileşimini ve kimyasal yapısını temsil eder.
Sülfürik Asitin molar kütlesi
Sülfürik asidin molar kütlesi 98,08 g/mol’dür. Sülfürik asitin (H2SO4) kimyasal formülündeki her bir elementin atomik kütlelerinin eklenmesiyle hesaplanır.
Sülfürik asidin kaynama noktası
Sülfürik asitin kaynama noktası 337,1°C’dir. Bu sıcaklıkta sıvının buhar basıncı atmosfer basıncına ulaşır ve kaynamaya başlar.
Sülfürik asidin erime noktası
Sülfürik asidin erime noktası 10,4°C’dir. Oda sıcaklığında çok viskoz bir sıvıdır, ancak daha düşük sıcaklıklarda donarak katı hal oluşturabilir.
Sülfürik asit yoğunluğu g/ml
Sülfürik asidin yoğunluğu, konsantrasyonuna bağlı olarak 1,84 g/mL ila 1,93 g/mL arasında değişir. Sülfürik asitin konsantrasyonu arttıkça yoğunluğu da artar.
Sülfürik asidin moleküler ağırlığı
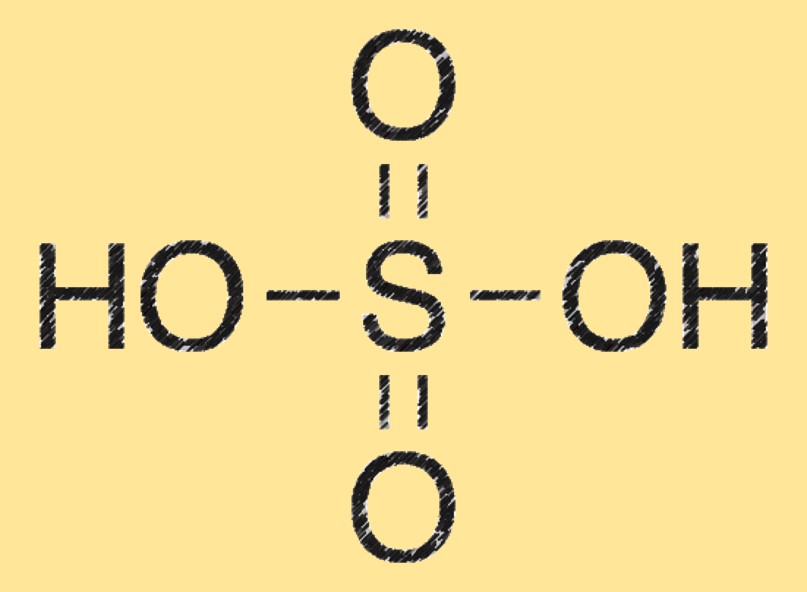
Sülfürik asidin moleküler ağırlığı 98,08 g/mol’dür. Her elementin atomik kütlelerinin kimyasal formülüne (H2SO4) eklenmesiyle hesaplanır.
Sülfürik asidin yapısı
Sülfürik asit molekülü, bir sülfür (S) atomuna bağlı iki hidrojen (H) atomundan ve aynı zamanda dört oksijen (O) atomuna da bağlı olarak oluşur. Dört yüzlü bir moleküler geometriye sahiptir ve güçlü bir dehidrasyon maddesidir.
| Dış görünüş | Berrak, renksiz, yağlı sıvı |
| Spesifik yer çekimi | 1,84 (su = 1) |
| Renk | Renksiz |
| Koku | Keskin ve kükürt kokusu |
| Molar kütle | 98.079 gr/mol |
| Yoğunluk | 1.835 g/mL |
| Füzyon noktası | 10,5°C |
| Kaynama noktası | 337°C |
| Flaş noktası | 60°C (140°F) |
| sudaki çözünürlük | Tamamen karışabilir |
| çözünürlük | Su ve alkolde çözünür |
| Buhar basıncı | 40 mmHg (20°C) |
| Buhar yoğunluğu | 2,5 (hava = 1) |
| pKa | -3 |
| pH | 1’den az (güçlü asidik) |
Sülfürik Asitin Güvenliği ve Tehlikeleri
Sülfürik asit oldukça aşındırıcı ve tehlikeli bir maddedir. Cilt ve gözlerle teması ciddi yanıklara ve körlüğe neden olabilir. Buharlarının solunması solunum sistemini tahriş edebilir ve öksürüğe, hırıltıya ve nefes darlığına neden olabilir. Yanıcı ve reaktiftir ve iyi havalandırılmış bir alanda, eldiven ve göz koruması gibi koruyucu ekipmanlar kullanılarak dikkatle kullanılmalıdır. Yüzeylere zarar vermemek ve potansiyel olarak insanlara zarar vermemek için dökülmeler derhal temizlenmelidir. Güvenli kullanımı sağlamak için uygun depolama ve etiketleme gereklidir.
| Tehlike sembolleri | Aşındırıcı, Tahriş Edici, Zararlı |
| Güvenlik Açıklaması | Isıdan/kıvılcımdan/açık alevden/sıcak yüzeylerden uzak tutun. Sigara İçmek Yasaktır. İyi havalandırılmış bir alanda saklayın. Kabı sıkıca kapalı tutun. Koruyucu eldiven/koruyucu kıyafet/göz koruyucu/yüz koruyucu kullanın. |
| BM kimlik numaraları | UN1830 |
| HS kodu | 2815.11.00 |
| Tehlike sınıfı | 8 |
| Paketleme grubu | II |
| Toksisite | Ağızdan: LD50 = 1,2 g/kg (Sıçan) |
Sülfürik asit sentezi için yöntemler
H2SO4, temas işlemi ve ana oda işlemi de dahil olmak üzere çeşitli yöntemlerle sentezlenebilir.
Temas işlemi, sülfürik asidin endüstriyel üretimi için en yaygın kullanılan yöntemdir; bu yöntem, sülfür dioksitin sülfür trioksite oksidasyonunu ve ardından sülfür trioksitin su ile reaksiyona girerek H2SO4 üretmesini içerir.
Öte yandan kurşun odası işlemi, bir katalizör (genellikle kurşun dioksit) varlığında kükürt dioksitin nitrojen dioksit ile oksidasyonunu ve daha sonra elde edilen kükürt trioksitin suyla reaksiyona sokulmasını içerir. Her iki yöntem de, gerektiğinde daha fazla saflaştırılabilen ve konsantre edilebilen, farklı saflık ve konsantrasyon seviyelerinde H2SO4 üretir.
Sülfürik Asitin Kullanım Alanları
H2SO4 çok yönlü bir kimyasaldır ve çeşitli endüstrilerde yaygın olarak kullanılır. İnsanlar genellikle gübre, deterjan, boya ve pigment üretiminde sülfürik asit kullanırlar. Ayrıca petrol ürünlerinin rafine edilmesinde, minerallerin ve cevherlerin işlenmesinde, nitrik asit ve sülfatlar gibi kimyasalların üretiminde de rol oynar. Laboratuvarlar H2SO4’ü reaktif olarak kullanır ve kimyasal reaksiyonlarda katalizör görevi görür. Kurşun asitli akülerde elektrolit olarak sülfürik asit kullanılır ve çelik üreticileri bunu kaplama veya boyama öncesinde pası ve tortuyu gidermek için dekapaj amacıyla kullanırlar.
Genel olarak H2SO4 birçok endüstriyel süreçte önemli bir rol oynar ve bu da onu dünyadaki en önemli kimyasallardan biri yapar.
Sorular:
Sülfürik asit güçlü bir asit midir?
Evet H2SO4 güçlü bir asittir. Güçlü asit, suda tamamen ayrışarak hidrojen iyonları (H+) üreten asittir; yani tüm hidrojen iyonlarını çözeltiye verir. En güçlü asitlerden biri olarak kabul edilen sülfürik asit, yüksek asit seviyesine sahiptir, bu da onu çok reaktif ve aşındırıcı yapar. İnsanlara ve çevreye zarar vermemek için sülfürik asidin uygun şekilde işlenmesi ve depolanması önemlidir.
Sülfürik asit ne için kullanılır?
Sülfürik asit çeşitli endüstrilerde ve uygulamalarda yaygın olarak kullanılmaktadır. H2SO4’ün en yaygın kullanımlarından bazıları şunlardır:
- Gübre üretimi: Sülfürik asit, birçok gübrenin temel bileşeni olan fosforik asit üretiminde kullanılmaktadır.
- Petrol rafinasyonu: Sülfürik asit, rafinasyon işlemi sırasında ham petrolden kükürt bileşikleri gibi yabancı maddeleri uzaklaştırmak için kullanılır.
- Metal İşleme: Sülfürik asit, metal işlemede demir ve çelikten pası ve tortuyu çıkarmak ve metal cevherlerini rafine etmek için kullanılır.
- İmalat: Sülfürik asit, deterjanlar, boyalar, pigmentler ve diğer kimyasallar dahil olmak üzere çeşitli ürünlerin üretiminde kullanılır.
- Otomotiv aküleri: Sülfürik asit, genellikle otomobillerde ve diğer araçlarda kullanılan kurşun-asit akülerde elektrolit olarak kullanılır.
- Laboratuvar Reaktifi: Sülfürik asit, yüksek reaktivite seviyesi ve birçok maddeyi çözme yeteneği nedeniyle yaygın olarak laboratuvar reaktifi olarak kullanılır.
Sülfürik asit ne tür bir asittir?
H2SO4 güçlü bir inorganik asittir. Diprotik asit olarak sınıflandırılan H2SO4, bir çözeltiye iki hidrojen iyonu (H+) vererek onu güçlü bir mineral asit haline getirir. Oldukça reaktif ve aşındırıcı yapısı nedeniyle, H2SO4’ün taşınması ve saklanması sırasında insanlara ve çevreye zarar vermemesine dikkat edilmelidir. Endüstriler, gübre, deterjan, boya, pigment ve diğer kimyasalların üretiminin yanı sıra petrol ürünlerinin rafine edilmesi ve metal cevherlerinin işlenmesi de dahil olmak üzere süreçlerinde sülfürik asidi yaygın olarak kullanır.
Sülfürik asidin formülü nedir?
Sülfürik asidin kimyasal formülü H2SO4’tür.
Vitiol yağı nedir?
Vitriol yağı, güçlü ve son derece aşındırıcı bir kimyasal olan sülfürik asit için başka bir terimdir. Gübre, deterjan ve boya üretiminde, petrol rafinasyonunda ve diğer kimyasalların işlenmesinde yaygın olarak kullanılır.
