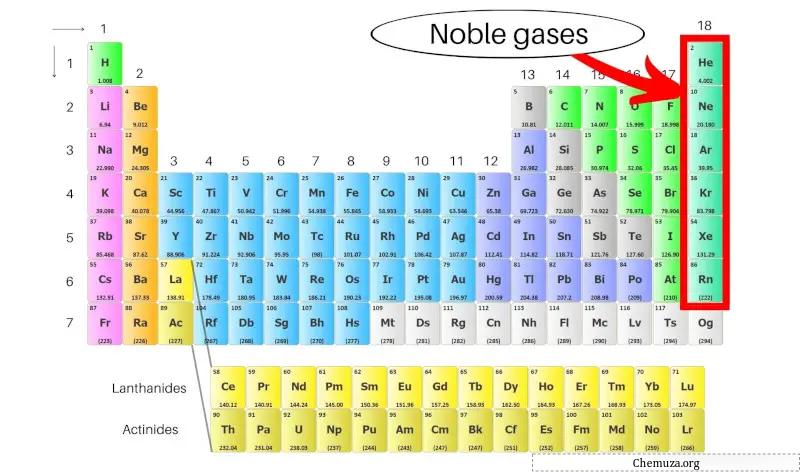
Asal gazlar olarak da adlandırılan soy gazlar, periyodik tablonun en sağ sütununda yer alan bir grup elementtir. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) içerir.
Bu elementler, en dıştaki eksiksiz elektronik kabukları nedeniyle düşük reaktiviteleriyle bilinir, bu da onları diğer elementlerle kararlı ve tepkisiz hale getirir. [1]
Periyodik tablodaki soy gazları daha fazla inceleyelim.
Soy gazlar nelerdir?
Soy gazlar, diğer maddelerle çok düşük reaktiviteleri ile karakterize edilen Grup 18 elementleridir; bu da genellikle diğer elementlerle bileşik oluşturmadıkları anlamına gelir.
Çok kararlı oldukları ve diğer maddelerle kolayca reaksiyona girmedikleri için inert gazlar olarak da adlandırılırlar. Soy gazlar arasında helyum, neon, argon, kripton, ksenon ve radon bulunur.
Soy gazlar Dünya atmosferinde küçük miktarlarda bulunur ve aydınlatma, kaynak ve kriyojenik gibi çeşitli uygulamalarda kullanılır. [2]
Neden soylu inert gazlardır?
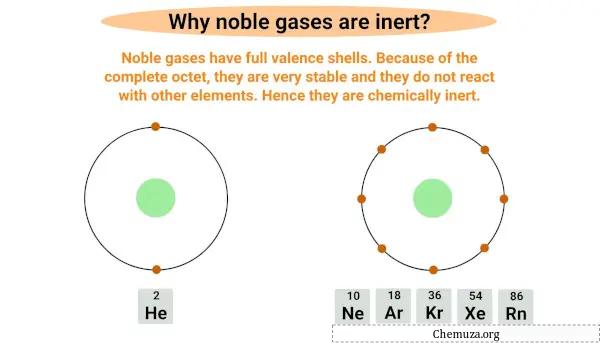
Soygazlar inerttir veya reaktif değildir çünkü değerlik kabuğu olarak da bilinen en dıştaki elektron kabuğunun tamamına sahiptirler.
Değerlik kabuğu, bir atomu çevreleyen ve kimyasal reaksiyonlara katılan elektronlar olan değerlik elektronlarını içeren en dıştaki elektron kabuğudur.
Soygazlar tam oktettir , yani en dış kabuğunda yalnızca iki elektron bulunan helyum dışında sekiz elektronlu tam değerlik kabuğuna sahiptirler.
Tam bayta sahip olmak onları çok kararlı hale getirir ve diğer öğelerle reaksiyona girme olasılığını azaltır.
Kimyasal reaksiyonlarda elementler, değerlik kabuklarında tam bir oktet kazanmak için elektron kazanma veya kaybetme eğilimindedir, ancak soy gazlar zaten tam bir değerlik kabuğuna sahip olduğundan, elektron kazanmaları veya kaybetmeleri gerekmez.
Nadir gazların bu kararlı konfigürasyonu elektronik konfigürasyonlarından kaynaklanmaktadır.
Bu elementlerin en dıştaki elektron kabuğu dolu olduğundan elektron almaları veya kaybetmeleri gerekmez.
Bu onların çok tepkisiz oldukları ve diğer elementlerle kimyasal bağ kurma eğiliminde olmadıkları anlamına gelir.
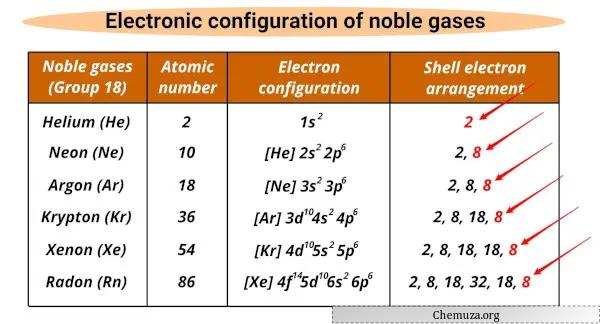
Soy gazların listesi ve elektronik konfigürasyonları
Soy gazlar ve elektronik konfigürasyonları aşağıda gösterilmiştir.
Tüm soy gazların ortak özelliği nedir?
Soy gazlar bazı ortak özelliklere sahiptir.
Helyum hariç hepsi aynı sayıda değerlik elektronuna (8) sahiptir.
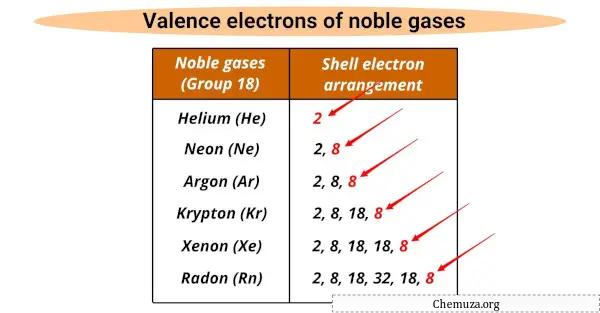
Değerlik elektronları, bir atomun kimyasal reaksiyonlara katılan en dıştaki elektronlarıdır ve soy gazlar, onları reaktif olmayan hale getiren dolu bir değerlik kabuğuna sahiptir.
Ayrıca soy gazlar göremediğimiz renksiz gazlardır ve aynı zamanda kokusuzdur , yani kokusu yoktur. [3]
Son olarak, doğal olarak tek atomlu gazlar halinde bulunurlar, yani temel formlarında yalnızca bir atom bulunur.
Diğer atomlara bağlanarak molekül oluşturma eğiliminde olan diğer elementlerin çoğundan farklı olarak soy gazların diğer atomlara bağlanmasına gerek yoktur çünkü tam bir değerlik kabuğuna sahiptirler, bu da onları çok kararlı ve reaktif değildir.
Özet
Soy gazlar, periyodik tablonun en sağ sütununda bulunan, helyum, neon, argon, kripton, ksenon ve radon dahil olmak üzere bir grup elementtir.
Tamamen harici elektronik katmanları nedeniyle düşük reaktiviteleriyle karakterize edilirler. Soy gazlar inerttir veya reaktif değildir çünkü tam değerli bir kabuğa sahiptirler, bu da onları çok kararlı kılar ve diğer elementlerle reaksiyona girme olasılıklarını azaltır.
Soy gazlar, aynı sayıda değerlik elektronu (2 olan helyum hariç 8), renksiz ve kokusuz bir gaz gibi ortak özelliklere sahiptir ve doğal olarak tek atomlu gazlar olarak bulunur.
Aydınlatma, kaynak ve kriyojenik gibi çeşitli uygulamaların yanı sıra nükleer reaktörlerdeki soğutucularda ve akkor ampuller için dolgu maddesi olarak kullanılırlar.
