Sönmemiş kireç olarak da bilinen kalsiyum oksit, yüksek erime noktasına sahip beyaz, alkali bir maddedir. Kalsiyum hidroksit üretmek için suyla kuvvetli bir şekilde reaksiyona girer ve önemli miktarda ısı üretir. Çimento üretimi, tarım ve su arıtma gibi çeşitli endüstriyel uygulamalarda kullanılır.
| IUPAC Adı | Kalsiyum oksit |
| Moleküler formül | CaO |
| CAS numarası | 1305-78-8 |
| Eş anlamlı | Sönmemiş kireç; Yanmış kireç; Kireç; Calx; Sönmemiş kireç; Kalsiyum (II) oksit; Kalsiya; Kireç çakıl taşı; Kireçtaşı kayası; Kalsiyum monoksit; Fondan kireç |
| InChI | InChI=1S/Ca.O |
Kalsiyum oksidin özellikleri
Kalsiyum Oksit Formülü
Kalsiyum oksidin kimyasal formülü CaO’dur; bu, onun bir kalsiyum katyonu (Ca2+) ve bir oksit anyonu (O2-) içerdiğini gösterir. Kalsiyum oksidin formülü, kalsiyum katyonlarının ve oksit anyonlarının güçlü elektrostatik kuvvetlerle bir arada tutulduğu iyonik doğasını yansıtır. Kalsiyum oksit formülü, çeşitli kimyasal reaksiyonlardaki bileşiği tanımlamak ve molekül ağırlığını ve diğer fiziksel özelliklerini hesaplamak için kullanılır.
Kalsiyum Oksit Molar Kütlesi
Sönmemiş kireç olarak da bilinen kalsiyum oksidin molar kütlesi, mol başına 56.077 gramdır. Bileşiği oluşturan kalsiyumun (40.078 g/mol) ve oksijenin (15.999 g/mol) atom ağırlığından türetilir. Kalsiyum oksidin molar kütlesi, belirli bir miktarda ürün üretmek için gereken reaktan miktarının belirlenmesi veya bir çözeltinin konsantrasyonunun hesaplanması gibi çeşitli hesaplamalarda kullanılır.
Kalsiyum oksitin kaynama noktası
Kalsiyum oksidin kaynama noktası yoktur çünkü kaynama yerine yüksek sıcaklıklarda termal bozunmaya uğrar. 2572°C’nin üzerindeki sıcaklıklarda kalsiyum oksit, kalsiyum ve oksijene ayrışır. Bununla birlikte, kalsiyum oksidin termal ayrışması, endüstriyel uygulamalar için daha yüksek saflığa ve reaktiviteye sahip kalsiyum oksidin üretilmesi için kullanılabilir.
Kalsiyum Oksit Erime Noktası
Kalsiyum oksidin erime noktası 2572°C’dir, bu da onu yüksek erime noktalı bir madde yapar. Kalsiyum katyonlarının ve oksit anyonlarının güçlü elektrostatik kuvvetler tarafından bir arada tutulduğu iyonik yapısı nedeniyle yüksek bir erime noktasına sahiptir. Kalsiyum oksidin yüksek erime noktası aynı zamanda onu çelik ve çimento üretimi gibi yüksek sıcaklık uygulamalarında da faydalı kılar.
Kalsiyum oksit yoğunluğu g/ml
Kalsiyum oksidin yoğunluğu, kristal yapısına ve saflığına bağlı olarak değişir. Kalsiyum oksidin tipik yoğunluğu dökme malzeme için 3,35 g/mL iken teorik yoğunluk 3,50 g/mL’dir. Kalsiyum oksidin düşük yoğunluğu, havadaki nemi emmesine ve ağırlığını ve hacmini artırmasına olanak tanıyan gözenekli yapısından kaynaklanmaktadır.
Kalsiyum Oksit Molekül Ağırlığı
Formül ağırlığı veya molar kütle olarak da adlandırılan kalsiyum oksidin moleküler ağırlığı, mol başına 56.077 gramdır. Bileşiği oluşturan kalsiyum ve oksijenin atom ağırlıkları toplanarak hesaplanır. Kalsiyum oksidin moleküler ağırlığı, belirli bir miktarda ürün üretmek için gereken reaktan miktarının belirlenmesi veya bir çözeltinin konsantrasyonunun hesaplanması gibi çeşitli hesaplamalarda kullanılır.
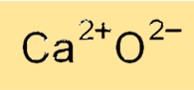
Kalsiyum oksitin yapısı
Kalsiyum oksit, kalsiyum katyonlarının ve oksit anyonlarının yüz merkezli kübik bir kafes içinde düzenlendiği kübik bir kristal yapıya sahiptir. Kalsiyum oksidin kristal yapısı sodyum klorür ve diğer iyonik bileşiklerinkine benzer. Kalsiyum oksidin iyonik yapısı, onu iyi bir elektrik yalıtkanı ve elektronik bileşenlerin üretiminde önemli bir malzeme haline getirir.
| Dış görünüş | Beyaz, kokusuz katı |
| Spesifik yer çekimi | 3,35 g/cm³ |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 56.077 gr/mol |
| Yoğunluk | 3,35 g/cm³ |
| Füzyon noktası | 2572°C |
| Kaynama noktası | Kaynamaz, termal ayrışmaya uğrar |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Kalsiyum hidroksit oluşturmak üzere suyla reaksiyona girer |
| çözünürlük | Suda çözünmez, asitte çözünür |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | 12-13 |
Kalsiyum Oksit Güvenliği ve Tehlikeleri
Sönmemiş kireç olarak da bilinen kalsiyum oksit, insan sağlığına ve çevreye çeşitli tehlikeler oluşturan oldukça reaktif ve yakıcı bir maddedir. Doğru şekilde kullanılmazsa ciltte, gözlerde ve solunum sisteminde ciddi tahrişe ve yanıklara neden olabilir. Sönmemiş kireç tozunun veya buharının solunması solunum sıkıntısına, öksürüğe ve nefes darlığına neden olabilir. Aynı zamanda suyla çok reaktiftir ve büyük miktarlarda ısı açığa çıkararak yanıklara ve buhar patlamalarına neden olabilir. sönmemiş kireç serin, kuru, iyi havalandırılmış bir alanda, uyumsuz maddelerden uzakta saklanmalıdır. Kazaları ve maruziyetleri önlemek için uygun koruyucu ekipman ve taşıma prosedürleri takip edilmelidir.
| Tehlike sembolleri | Aşındırıcı (C) |
| Güvenlik Açıklaması | Eldiven, kıyafet ve göz/yüz koruması kullanın. Dikkatli bir şekilde kullanın ve saklayın. Teneffüs etmekten, yutmaktan ve cilt ve gözlerle temasından kaçının. |
| BM kimlik numaraları | UN1910 |
| HS kodu | 2522.20.00 |
| Tehlike sınıfı | 8 – Aşındırıcı maddeler |
| Paketleme grubu | II |
| Toksisite | Çok zehirli |
Kalsiyum oksit sentez yöntemleri
Kireçtaşının termal ayrışması, kalsiyum hidroksitin ısı ile reaksiyonu ve kalsiyum klorürün elektrolizi, kalsiyum oksit veya sönmemiş kireci sentezler.
Sönmemiş kireci sentezlemenin en yaygın yöntemi, kirecin bir kireç fırınında yaklaşık 900 ila 1000°C gibi yüksek bir sıcaklığa ısıtılmasıdır. Kalsinasyon olarak bilinen bu işlem karbondioksit açığa çıkarır ve sönmemiş kirecin arkasında kalır. Sönmemiş kirecin işlenmesi ve öğütülmesi, birden fazla uygulama için ince bir toz üretir.
Sönmemiş kireci sentezlemenin başka bir yöntemi, sönmüş kireç olarak da bilinen kalsiyum hidroksitin yüksek bir sıcaklığa ısıtılmasını içerir. Dehidroksilasyon olarak bilinen bu işlem aynı zamanda su açığa çıkarır ve sönmemiş kirecin arkasında kalır.
Kalsiyum klorür elektrolizi sönmemiş kirecin sentezlenmesi için daha az yaygın bir yöntemdir. Kalsiyum klorürü suda çözün ve sönmemiş kireç ve klor gazı üretmek için çözeltiden elektrik akımı geçirin.
Kalsiyum Oksit Kullanım Alanları
Sönmemiş kireç olarak da bilinen kalsiyum oksit, benzersiz özellikleri nedeniyle çeşitli endüstrilerde birçok kullanıma sahiptir. Başlıca kullanımlarından bazıları şunlardır:
- Çelik Üretimi: Çelik üretiminde, yabancı maddelerin giderilmesine ve çeliğin kalitesinin iyileştirilmesine yardımcı olan bir akış maddesi olarak kullanılır.
- Su Arıtma: Su arıtımında yabancı maddeleri gidermek ve suyun pH’ını ayarlamak için kullanılır.
- Tarım: Tarımda toprağın pH’ını ayarlamak ve bitkilere gerekli besinleri sağlamak için toprak iyileştirici olarak kullanılır.
- Kimya endüstrisi: Kalsiyum karbür, kalsiyum hipoklorit ve kalsiyum stearat gibi kimyasalların üretiminde kullanılır.
- İnşaat: İnşaat sektöründe çimento, harç ve sıva bileşeni olarak kullanılır.
- Gıda sektörü: Gıda sektöründe sıkılaştırıcı ve asitlik düzenleyici olarak kullanılır.
- Kağıt Endüstrisi: Kağıt endüstrisinde kraft hamuru üretim prosesinde kullanılan beyaz likörün bir bileşeni olarak kullanılır.
- Petrol Endüstrisi: Petrol endüstrisinde rafinasyon prosesinde katalizör olarak kullanılır.
Sorular:
Soru: Kalsiyum oksidin formülü nedir?
C: Kalsiyum oksidin formülü CaO’dur.
S: Kalsiyumun oksidasyon sayısı nedir?
C: Kalsiyumun kalsiyum oksit içindeki oksidasyon sayısı +2’dir.
S: Kalsiyum oksit iyonik mi yoksa kovalent mi?
A: Kalsiyum oksit, pozitif yüklü kalsiyum iyonları ve negatif yüklü oksit iyonlarından oluşan iyonik bir bileşiktir.
S: Kalsiyum oksit katı mıdır?
C: Evet, kalsiyum oksit standart oda sıcaklığı ve basıncında katıdır. Beyaz veya grimsi beyaz bir görünüme sahiptir ve oldukça reaktiftir.
