Sodyum tiyosülfat, Na2S2O3 formülüne sahip kimyasal bir bileşiktir. Genellikle fotoğraf işlemede sabitleyici olarak ve bazı kimyasal reaksiyonlarda indirgeyici madde olarak kullanılır.
| IUPAC Adı | Sodyum tiyosülfat |
| Moleküler formül | Na2S2O3 |
| CAS numarası | 7772-98-7 |
| Eş anlamlı | Sodyum hiposülfit, sodyum tiyosülfat, tiyosülfürik asidin disodyum tuzu, sodyum tiyosülfat pentahidrat |
| InChI | InChI=1S/2Na.H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Sodyum tiyosülfatın özellikleri
Sodyum Tiyosülfat Formülü
Sodyum tiyosülfatın kimyasal formülü Na2S2O3’tür. İki Na+ iyonu ve iki S2O3 2- iyonundan oluşur. Formül, bileşiğin bir molekülünde bulunan atomların türlerini ve sayısını gösterir.
Sodyum Tiyosülfat Molar Kütlesi
Na2S2O3’ün molar kütlesi 158,11 g/mol’dür. Bileşiğin bir molünde bulunan tüm atomların atomik kütlelerinin eklenmesiyle hesaplanır. Bu değer, belirli bir reaksiyon için gerekli olan Na2S2O3 miktarının belirlenmesinde veya bir çözeltinin konsantrasyonunun hesaplanmasında faydalıdır.
Sodyum tiyosülfatın kaynama noktası
Na2S2O3 kaynama noktasına ulaşmadan ayrıştığı için kaynama noktası yoktur. Normal basınçta 48 ile 55°C arasında ayrışır ve kükürt dioksit açığa çıkarır. Bu özellik onu yüksek sıcaklık uygulamaları için uygunsuz hale getirir.
Sodyum tiyosülfat Erime noktası
Na2S2O3’ün erime noktası 48,3°C’dir. Bu, katı bileşiğin sıvıya dönüştüğü sıcaklıktır. Erime noktası diğer inorganik tuzlara göre nispeten düşüktür, bu da suda çözünmesini kolaylaştırır.
Sodyum tiyosülfatın yoğunluğu g/mL
Na2S2O3’ün yoğunluğu 1,667 g/mL’dir. Bu değer, maddenin birim hacim başına kütlesini ifade eder. Suyun yoğunluğundan daha büyüktür, bu da Na2S2O3’ün suda batması anlamına gelir.
Sodyum Tiyosülfat Molekül Ağırlığı
Na2S2O3’ün moleküler ağırlığı 158,11 g/mol’dür. Bir bileşiğin molekülünde bulunan tüm atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı, belirli bir reaksiyon için gerekli olan Na2S2O3 miktarını belirlemek veya bir çözeltinin konsantrasyonunu hesaplamak için faydalıdır.
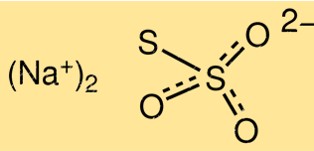
Sodyum tiyosülfatın yapısı
Na2S2O3’ün yapısı, bir sodyum iyonu olan Na+’ya bağlı iki S2O3 2- iyonundan oluşur. Molekül, yaklaşık 103 derecelik bir bağ açısına sahip bir üçgen piramit şekline sahiptir. Tiyosülfat iyonunun bir kükürt-kükürt bağı ve iki kükürt-oksijen bağı vardır.
Sodyum tiyosülfatın çözünürlüğü
Na2S2O3 suda çok çözünür. Na2S2O3’ün sudaki çözünürlüğü sıcaklıkla artar, yaklaşık 70 g bileşik 25°C’de 100 ml su içinde çözülür. Ayrıca gliserolde çözünür ve alkolde az çözünür. Çözünürlüğü onu fotoğraf işleme ve tıbbi tedaviler gibi çeşitli uygulamalarda faydalı kılar.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yer çekimi | 1.667 g/mL |
| Renk | Renksizden beyaza |
| Koku | Kokusuz |
| Molar kütle | 158,11 gr/mol |
| Yoğunluk | 1.667 g/mL |
| Füzyon noktası | 48,3°C |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çok çözünür |
| çözünürlük | Gliserolde çözünür ve alkolde az çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Nötr (pH 7) |
Sodyum tiyosülfatın güvenliği ve tehlikeleri
Na2S2O3, doğru şekilde kullanıldığında genellikle güvenli kabul edilir. Ancak yutulması, solunması veya göz veya cilt ile teması halinde zararlı olabilir. Bileşik ciltte ve gözde tahrişe neden olabilir ve uzun süreli maruz kalma dermatite neden olabilir. Na2S2O3’ün yutulması mide bulantısı ve kusma gibi mide-bağırsak rahatsızlıklarına neden olabilir. Na2S2O3 ile çalışırken eldiven ve koruyucu gözlük gibi uygun kişisel koruyucu ekipmanların kullanılması önemlidir. Maruz kalınması durumunda, etkilenen bölge suyla yıkanmalı ve gerekirse tıbbi yardım alınmalıdır.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Göz, cilt ve giysilerle temasından kaçının. Yemeyin. Uygun kişisel koruyucu ekipman giyin. |
| BM kimlik numaraları | UN3077 |
| HS kodu | 2832.3010.00 |
| Tehlike sınıfı | 9 |
| Paketleme grubu | III |
| Toksisite | Düşük toksisite; LD50 (oral, sıçan) 6.200 mg/kg’dır |
Sodyum tiyosülfatın sentezi için yöntemler
Na2S2O3 çeşitli yöntemlerle sentezlenebilir.
Yaygın bir yöntem, alkalin bir çözelti varlığında sodyum sülfitin kükürt ile reaksiyona sokulmasıdır. Başka bir yöntem, sodyum sülfitin basınç altında kükürt dioksit ile reaksiyona sokulmasını içerir.
Na2S2O3 hazırlamanın bir yöntemi, kükürtün sıcak bir sodyum sülfit ve sodyum hidroksit çözeltisi içinde çözülmesidir. Çözelti soğur ve birisi katı bir ürün elde etmek için onu filtreler.
Bu yöntemde, kükürt dioksit, sodyum sülfit üretmek için sodyum hidroksit ile reaksiyona sokulur ve daha sonra Na2S2O3 üretmek için elementel kükürt ile reaksiyona sokulur.
Na2S2O3 üretmek için sülfürik asit, sodyum sülfit ile reaksiyona sokulabilir, daha sonra elde edilen çözelti ısıtılabilir ve kükürt eklenebilir. Daha sonra sodyum sülfit kükürt ile reaksiyona girerek Na2S2O3’ü oluşturacaktır.
Başka bir yöntem, sodyum hidroksitin kükürt ile reaksiyona sokulmasını ve ardından Na2S2O3 oluşturmak üzere sodyum sülfitin eklenmesini içerir.
Sodyum tiyosülfatın kullanım alanları
Na2S2O3’ün çeşitli endüstrilerde ve uygulamalarda geniş bir kullanım alanı vardır:
- Fotoğrafçılık: Pozlanmamış gümüş halojenürü fotoğraf baskılarından ve filmlerden çıkarmak için sabitleme maddesi olarak kullanılır.
- Su Arıtma: Kloru nötralize ederek sudaki kloru gidermek ve su canlıları üzerindeki zararlı etkilerini önlemek için kullanılır.
- Tıbbi uygulamalar: Siyanürle reaksiyona girerek daha az toksik olan ve vücuttan atılabilen tiyosiyanat oluşturduğu için siyanür zehirlenmesinin tedavisinde kullanılır.
- Endüstriyel Uygulamalar: Kimyasal işlemlerde indirgeyici madde olarak ve tekstil, deri ve kağıtta koruyucu olarak kullanılır.
- Analitik Kimya: Bakır ve arsenik gibi çeşitli metallerin analizinde titrant olarak kullanılır.
- Yiyecek ve içecek endüstrisinde: Gıdalarda renk bozulmasını önlemek amacıyla koruyucu ve lezzet arttırıcı olarak kullanılır.
- Bahçe Bitkileri: Bitkilerin sulanmasında kullanılan sudaki klorun etkilerini nötralize etmek için kullanılır.
Sorular:
S: Sodyum tiyosülfat ne için kullanılır?
C: Na2S2O3’ün fotoğrafçılık, su arıtma, tıbbi tedaviler, endüstriyel işlemler, analitik kimya, yiyecek ve içecek muhafazası ve bahçecilik dahil olmak üzere geniş bir uygulama yelpazesi vardır.
S: Sodyum tiyosülfat nasıl yapılır?
A: Na2S2O3, alkalin bir çözelti varlığında sodyum sülfitin kükürt veya kükürt dioksit ile reaksiyona sokulmasıyla sentezlenebilir. Diğer yöntemler, sodyum sülfit üretmek için sodyum hidroksitin kükürt veya kükürt dioksit ile reaksiyona sokulmasını ve daha sonra Na2S2O3 üretmek üzere kükürt ile reaksiyona sokulmasını içerir.
S: Sodyum altın tiyosülfat nedir?
A: Altın Na2S2O3, altın klorür ile Na2S2O3’ün reaksiyonundan oluşan kompleks bir bileşiktir. Altın kaplama ve analitik kimyada altını tespit etmek ve ölçmek için kullanılır.
S: Sodyum tiyosülfat nereden satın alınır?
C: Na2S2O3 kimyasal tedarikçilerden, laboratuvar tedarik şirketlerinden ve çevrimiçi perakendecilerden satın alınabilir.
S: Sodyum tiyosülfatı nerede bulabilirim?
C: Na2S2O3, fotoğraf kimyasalları, su arıtma ürünleri ve tıbbi tedaviler dahil olmak üzere çeşitli ürünlerde bulunabilir.
Soru: Na2S2O3’teki kükürtün oksidasyon sayısı nedir?
C: Na2S2O3’teki kükürtün oksidasyon sayısı, tiyosülfat iyonunda (S2O3^2-) +2 ve sülfat iyonunda (SO4^2-) +6’dır.
S: Na2S2O3 titrasyonundan Cu’nun ağırlığı nasıl bulunur?
C: Cu’nun ağırlığı, Cu ve Na2S2O3 arasındaki reaksiyon için dengeli kimyasal denklem kullanılarak titrasyonda kullanılan Na2S2O3 çözeltisinin hacminden ve molaritesinden hesaplanabilir.
S: Stokiyometrik miktarda Na2S2O3 eklendiğini nasıl bileceksiniz?
C: Renkte veya diğer fiziksel veya kimyasal özelliklerde bir değişiklikle belirtildiği gibi, reaksiyonun bitiş noktasına ulaşıldığında stokiyometrik miktarda Na2S2O3 eklenmiştir.
Soru: 40 damla Na2S2O3’e 5 damla 0,15 M KI eklenirse KI’nin son konsantrasyonu nedir?
C: KI’nin nihai konsantrasyonu, Na2S2O3 çözeltisinin hacmi veya konsantrasyonu gibi ek bilgiler olmadan belirlenemez.
S: Na2S2O3’ün molaritesini nasıl bulabilirim?
C: Na2S2O3’ün molaritesi, numunenin kütlesinden ve onu çözmek için kullanılan çözeltinin hacminden ve konsantrasyonundan Molarite = çözünen maddenin molü/litre cinsinden çözelti hacmi formülü kullanılarak hesaplanabilir.
