Sodyum sülfür (sülfür), Na2S formülüne sahip kimyasal bir bileşiktir. Kağıt ve kağıt hamuru endüstrisinde ve su arıtmada ağır metallerin uzaklaştırılmasında yaygın olarak kullanılır.
| IUPAC Adı | Disodyum sülfür |
| Moleküler formül | Na2S |
| CAS numarası | 1313-82-2 |
| Eş anlamlı | Sodyum sülfür, sodyum monosülfür, disodyum sülfür, susuz sodyum sülfür, susuz sodyum sülfür, sodyum sülfür |
| InChI | InChI=1S/2Na.S/q2*+1;-2 |
Sodyum sülfürün molar kütlesi
Sodyum sülfürün molar kütlesi 78.045 g/mol’dür. Bu, bir mol sodyum sülfürün 78.045 gram bileşik içerdiği anlamına gelir. Molar kütle, bir reaksiyon için gereken madde miktarının hesaplanmasında ve ayrıca bir bileşiğin moleküler ağırlığının belirlenmesinde yararlı olan bir miktardır.
Sodyum sülfürün kaynama noktası
Sodyum sülfit >1180°C (2156°F) gibi nispeten yüksek bir kaynama noktasına sahiptir. Bu, sodyum sülfürün katı formunu gaz formuna dönüştürmenin önemli miktarda enerji gerektirdiği anlamına gelir. Yüksek kaynama noktası aynı zamanda sodyum sülfürün yüksek sıcaklıklarda stabil bir bileşik olduğunu da gösterir.
Sodyum Sülfürün Erime Noktası
Sodyum sülfürün erime noktası 1,180°C’dir (2,156°F). Bu, sodyum sülfürün katı formunu sıvı formuna dönüştürmenin önemli miktarda enerji gerektirdiği anlamına gelir. Sodyum sülfürün yüksek erime noktası aynı zamanda yüksek sıcaklıklarda stabil bir bileşik olduğunu da gösterir.
Sodyum sülfürün yoğunluğu g/ml
Sodyum sülfürün yoğunluğu formuna bağlı olarak değişir. Sodyum sülfürün susuz formunun yoğunluğu 1,856 g/mL iken nonahidrat formunun yoğunluğu 1,58 g/mL’dir. Bir maddenin yoğunluğu birim hacim başına kütledir ve bir çözeltinin konsantrasyonunu belirlemek için yararlı bir miktardır.
Sodyum Sülfürün Molekül Ağırlığı
Sodyum sülfürün moleküler ağırlığı 78.045 g/mol’dür. Bu, bir mol sodyum sülfürün 6.022 x 10^23 bileşik molekülü içerdiği anlamına gelir. Molekül ağırlığı, bir bileşiğin molar kütlesinin belirlenmesinin yanı sıra, bir reaksiyon için gereken madde miktarının hesaplanmasında yararlı olan bir miktardır.
Sodyum sülfürün yapısı
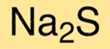
Sodyum sülfit susuz formunda kristal bir yapıya sahiptir. Bileşik, suda oldukça çözünür olan renksiz kristaller oluşturur. Bileşiğin yapısı sodyum katyonlarından (Na+) ve sülfit anyonlarından (S2-) oluşur. Bileşik, sodyum ve sülfür iyonları arasında güçlü bir iyonik bağa sahiptir.
Sodyum Sülfür Formülü
Sodyum sülfürün kimyasal formülü Na2S’dir. Bu, her bir sodyum sülfür molekülünün iki sodyum katyonu ve bir sülfür anyonu içerdiği anlamına gelir. Formül, bileşiğin kimyasal bileşimini anlamak ve özelliklerini belirlemek için kullanışlıdır.
| Dış görünüş | Sarıdan sarı-kahverengiye kadar katı, nemden eriyen |
| Spesifik yer çekimi | 1,856 (susuz), 1,58 (nahidratsız) |
| Renk | Renksizden sarıya |
| Koku | Çürük yumurta kokusu |
| Molar kütle | 78.045 gr/mol |
| Yoğunluk | 1,856 g/mL (susuz), 1,58 g/mL (nahidratsız) |
| Füzyon noktası | 1180°C (2156°F) |
| Kaynama noktası | >1180°C (2156°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çok çözünür |
| çözünürlük | Etanol, gliserolde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Alkali, pH ~12 |
Sodyum Sülfürün Güvenliği ve Tehlikeleri
Sodyum sülfür çeşitli güvenlik riskleri oluşturabilir. Suyla çok reaktiftir ve temas halinde ciddi cilt ve göz tahrişine neden olabilir. Bileşiğin solunması solunum yolu tahrişine neden olabilir ve yutulması halinde bulantı, kusma ve ishale neden olabilir. Bileşik aynı zamanda son derece yanıcıdır ve oksitleyici maddelerle şiddetli reaksiyona girebilir. Sodyum sülfitin dikkatle kullanılması ve eldiven ve gözlük gibi uygun koruyucu ekipmanların kullanılması önemlidir. Bileşiğin taşınması sırasında yeterli havalandırma da sağlanmalıdır. Maruz kalınması durumunda derhal tıbbi yardıma başvurulmalıdır.
| Tehlike sembolleri | Aşındırıcı, Toksik |
| Güvenlik Açıklaması | Tozunu/dumanını/gazını/sisini/buharını/spreyini solumayın. Koruyucu eldiven/koruyucu kıyafet/göz koruyucu/yüz koruyucu kullanın. SOLUNDUĞUNDA: Kazazedeyi temiz havaya çıkarın ve nefes alması kolay bir pozisyonda dinlenmesini sağlayın. GÖZ İLE TEMASI HALİNDE: Su ile birkaç dakika dikkatlice durulayın. Varsa ve yapılması kolaysa kontakt lensleri çıkarın. Durulamaya devam edin. CİLT (veya saç) İLE TEMAS HALİNDE İSE: Kirlenmiş tüm giysileri derhal çıkarın. Cildi su/duş ile durulayın. YUTULMASI HALİNDE: Ağzınızı çalkalayın. Kusturmaya ÇALIŞMAYIN. Derhal ZEHİR MERKEZİNİ veya doktoru arayın. |
| BİR tanımlayıcılar | UN1849 |
| HS kodu | 2830.10.00 |
| Tehlike sınıfı | 8 |
| Paketleme grubu | II |
| Toksisite | Çok zehirli; Yutulması halinde ciddi cilt ve göz tahrişine, solunum yolu tahrişine, bulantı, kusma ve ishale neden olabilir. Yutulduğunda öldürücü olabilir. |
Sodyum sülfit sentezi için yöntemler
Sodyum sülfürün sentezlenmesi için çeşitli yöntemler mevcuttur:
Yaygın bir yöntem, sodyum sülfit (Na2S) ve su (H2O) üretmek için sodyum hidroksitin (NaOH) yüksek sıcaklıktaki bir fırında kükürt (S) ile reaksiyona sokulmasıdır.
Başka bir yöntem, kükürt dioksitin (SO2) sodyum sülfit (Na2S) ile reaksiyona sokularak sodyum tiyosülfat (Na2S2O3) oluşturulmasını, ardından bunun sodyum hidroksit (NaOH) ile reaksiyona sokularak sodyum sodyum sülfit (Na2S) ve su (H2O) oluşturulmasını içerir.
Üçüncü bir yöntem, sodyum sülfit (Na2S), karbon dioksit (CO2) ve karbon monoksit (CO) üretmek için sodyum sülfatın (Na2SO4) yüksek sıcaklıklarda kömür varlığında karbonla indirgenmesini içerir.
Başka bir yöntem, sodyum sülfit (Na2S), karbon dioksit (CO2) ve karbon monoksit üretmek için sodyum karbonatın (Na2CO3) yüksek sıcaklıklarda odun kömürü varlığında kükürt (S) ile reaksiyona sokulmasını içerir. karbon (CO).
Sodyum sülfit sentezlemek için, sodyum sülfit nonahidrat (Na2S.9H2O), sodyum sülfat (Na2SO4) ve sülfür dioksit (SO2) üretmek üzere sülfürik asit (H2SO4) ile reaksiyona sokulabilir. Daha sonra, sodyum sülfit (Na2S) ve karbon dioksit (CO2) üretmek için sodyum sülfatı kömürle ısıtın.
Genel olarak, sodyum sülfürü sentezlemek için farklı yöntemler vardır ve belirli bir yöntemin seçilmesi, ürünün istenen saflığı, miktarı ve maliyet etkinliği gibi faktörlere bağlıdır.
Sodyum Sülfürün Kullanım Alanları
Sodyum sülfit, geniş bir kullanım alanıyla çeşitli endüstrilere hizmet vermektedir.
Deri endüstrisi bunu yaygın olarak derilerden kıl ve yünü çıkarmak için tüy dökücü bir madde olarak kullanır.
Tekstiller için kükürt boyaları üretmek için kükürtleştirici madde olarak ve sodyum hidrosülfit gibi diğer kimyasalların üretiminde indirgeyici madde olarak kullanılır.
Kağıt hamuru ve kağıt endüstrisinde, sodyum sülfit ağartma maddesi görevi görür ve ligninin kağıt hamurundan çıkarılmasına yardımcı olur.
Ayrıca madencilikte bakır, kurşun ve çinko cevherlerini ganglarından ayırmak için yüzdürme maddesi olarak da kullanılır.
Atık su arıtma endüstrisinde, ağır metalleri atık sulardan uzaklaştırmak için indirgeyici madde olarak sodyum sülfür kullanılır. Ek olarak, su arıtma proseslerinde klorsuzlaştırma maddesi olarak artık klorun giderilmesine yardımcı olur.
İlaç endüstrisi, bazı ilaçların üretiminde ve organik kimya reaksiyonlarında indirgeyici bir madde olarak sodyum sülfit kullanır.
Laboratuvarlar bunu analitik kimyada reaktif olarak ve kimyasal sentezde kükürt iyonları kaynağı olarak kullanır.
Genel olarak sodyum sülfür, çeşitli endüstrilerde çeşitli uygulamalara sahip çok yönlü bir bileşiktir. Eşsiz kimyasal özellikleri, onu diğerlerinin yanı sıra indirgeyici madde, tüy dökücü madde, yüzdürme maddesi ve klor giderici madde olarak faydalı kılar.
Sorular:
S: İyonik bileşik sodyum sülfürdeki katyonun yükü nedir?
C: Sodyum sülfürün katyonu +1 yükü olan sodyumdur (Na+).
Soru: Sodyum sülfürün formülü nedir?
A: Sodyum sülfürün formülü Na2S’dir; bu, bir sodyum katyonu (Na+) ve bir sülfür anyonundan (S2-) oluşan iyonik bileşiği temsil eder.
Soru: Sodyum sülfürün formülü nedir?
A: Sodyum sülfürün formülü Na2S’dir; bu, bir sodyum katyonu (Na+) ve bir sülfür anyonundan (S2-) oluşan iyonik bileşiği temsil eder.
S: Sodyum sülfür çözünür mü?
C: Sodyum sülfür, su ve etanol gibi polar çözücülerde çözünür, ancak benzen ve kloroform gibi polar olmayan çözücülerde çözünmez.
Soru: Sodyum sülfür suda çözünür mü?
C: Evet, sodyum sülfit suda oldukça çözünür ve oda sıcaklığında yaklaşık 50g/100ml’lik bir çözünürlüğe sahiptir. Sodyum sülfür suda çözündüğünde hidrolize uğrayarak sodyum hidroksit ve hidrojen sülfür gazı oluşturur.
