Na2SO3 olarak da bilinen sodyum sülfit, gıda endüstrisinde koruyucu olarak ve fotoğrafçılıkta indirgeyici madde olarak yaygın olarak kullanılan beyaz kristal bir tozdur.
| IUPAC Adı | Disodyum sülfit |
| Moleküler formül | Na2SO3 |
| CAS numarası | 7757-83-7 |
| Eş anlamlı | Sodyum sülfit; Disodyum sülfit; Sülfürik asit, disodyum tuzu; Sodyum sülfonat; Sodyum Sülfit |
| InChI | InChI=1S/2Na.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Sodyum sülfitin özellikleri
Sodyum Sülfit Formülü
Sodyum sülfitin kimyasal formülü Na2SO3’tür. İki Na+ iyonu ve bir SO32- iyonundan oluşur. Na+ iyonları pozitif yük taşırken, SO32- iyonu negatif yük taşır. Sodyum sülfit, beyaz kristal toz oluşturan iyonik bir bileşiktir.
Sodyum Sülfit Molar Kütlesi
Na2SO3’ün molar kütlesi 126,04 g/mol’dür. Bu değer, bileşikteki her bir elementin atomik kütlelerinin eklenmesiyle elde edilir. Sodyum, kükürt ve oksijenin atomik kütleleri sırasıyla 22,99 g/mol, 32,06 g/mol ve 15,99 g/mol’dür. Molar kütle, stokiyometrik hesaplamalarda kullanılan önemli bir parametredir ve aynı zamanda bir numunede bulunan madde miktarını belirlemek için de kullanılabilir.
Sodyum sülfitin kaynama noktası
Na2SO3’ün kaynama noktası 1650°C’dir. Bunun nedeni, kırılması için büyük miktarda enerji gerektiren Na+ ve SO32- iyonları arasındaki güçlü iyonik bağlardır. Kaynama noktası, bir maddenin sıvı fazdan gaz fazına geçtiği sıcaklıktır. Bu sıcaklıkta sıvının buhar basıncı atmosfer basıncına eşittir.
Sodyum Sülfit Erime Noktası
Na2SO3’ün erime noktası 33,4°C’dir. Bu nispeten düşük erime noktası, Na2SO3 molekülleri arasındaki zayıf moleküller arası kuvvetlerden kaynaklanmaktadır. Isıtıldığında moleküller arası kuvvetlerin üstesinden gelinir ve katı Na2SO3 sıvıya dönüşür.
Sodyum sülfitin yoğunluğu g/mL
Na2SO3’ün yoğunluğu 2,633 g/mL’dir. Yoğunluk, bir maddenin birim hacim başına kütlesi olarak tanımlanır. Na2SO3’ün yüksek yoğunluğu, iyonik yapısından ve yapısında sülfit iyonu başına iki sodyum iyonunun bulunmasından kaynaklanmaktadır.
Sodyum Sülfit Molekül Ağırlığı
Na2SO3’ün moleküler ağırlığı 126,04 g/mol’dür. Bu değer, bileşikteki her bir elementin atom ağırlığının eklenmesiyle elde edilir. Molekül ağırlığı stokiyometrik hesaplamalarda kullanılan önemli bir parametredir ve aynı zamanda bir numunede bulunan madde miktarını belirlemek için de kullanılabilir.
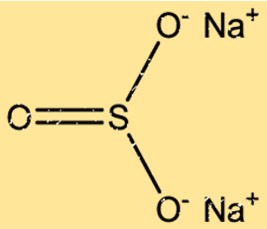
Sodyum sülfitin yapısı
Na2SO3, tekrar eden bir düzende düzenlenmiş iki Na+ iyonu ve bir SO32- iyonundan oluşan bir kristal yapıya sahiptir. Na+ iyonları yüzey merkezli kübik bir kafes içinde düzenlenirken, SO32- iyonları kafesin oktahedral bölgelerini işgal eder. Na+ ve SO32- iyonları arasındaki iyonik bağlar kararlı bir kristal yapıyla sonuçlanır.
Sodyum sülfitin çözünürlüğü
Na2SO3, 20°C’de 22,4 g/100 mL’lik bir çözünürlükle suda oldukça çözünür. Bu yüksek çözünürlük, Na2SO3’ün suda ayrışarak Na+ ve SO32- iyonları oluşturmasına olanak sağlayan iyonik yapısından kaynaklanmaktadır. Moleküllerin kinetik enerjisi arttıkça ve çözeltiye daha fazla iyon salındıkça Na2SO3’ün sudaki çözünürlüğü sıcaklıkla artar.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yer çekimi | 2,633 gr/cm³ |
| Renk | Renksizden beyaza |
| Koku | Kokusuz |
| Molar kütle | 126,04 gr/mol |
| Yoğunluk | 2.633 g/mL |
| Füzyon noktası | 33,4°C |
| Kaynama noktası | 1650°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çok çözünür |
| çözünürlük | Gliserolde çözünür, etanolde az çözünür |
| Buhar basıncı | 20°C’de 0 mmHg |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 6:35 sabah. |
| pH | 8,3 – 9,5 (%5 çözüm) |
Sodyum Sülfitin Güvenliği ve Tehlikeleri
Na2SO3 doğru şekilde kullanılmazsa tehlikeli olabilir. Ciltte ve gözlerde tahrişe neden olabilir ve yutulması halinde bulantı, kusma ve karın ağrısına neden olabilir. Ayrıca solunması halinde solunum yolu tahrişine de neden olabilir. Ayrıca Na2SO3 diğer kimyasallarla reaksiyona girerek kükürt dioksit gibi sağlığınıza zararlı olabilecek zehirli gazlar üretebilir. Bu nedenle Na2SO3 ile çalışırken uygun kişisel koruyucu ekipman giymek ve gözlere, cilde ve mukozalara maruz kalmaktan kaçınmak önemlidir. Na2SO3 aynı zamanda serin, kuru ve iyi havalandırılmış bir alanda, uyumsuz malzemelerden uzakta saklanmalıdır.
| Tehlike sembolleri | Xi,O |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının. Temas halinde derhal bol su ile yıkayın ve doktora başvurun. Yemeyin. Tozu solumaktan kaçının. Uygun kişisel koruyucu ekipman giyin. Isıdan, kıvılcımdan ve alevden uzak tutun. |
| BİR KİMLİK | 1384 |
| HS kodu | 283210 |
| Tehlike sınıfı | 8 – Aşındırıcı maddeler |
| Paketleme grubu | III |
| Toksisite | LD50 (oral, sıçan) – 1.640 mg/kg; LC50 (soluma, sıçan) – 63 mg/m³ |
Sodyum sülfitin sentezi için yöntemler
Na2SO3 çeşitli yöntemlerle sentezlenebilir.
Yaygın bir yöntem, sodyum hidroksitin su varlığında kükürt dioksit gazı ile reaksiyona sokulmasıdır. Reaksiyon, yan ürün olarak Na2SO3 ve su üretir.
Diğer bir yöntemde ise sodyum karbonat , su varlığında kükürt dioksit gazı ile reaksiyona girerek Na2SO3 ve karbondioksit gazı üretir. Na2SO3 verimini arttırmak için bu reaksiyon yüksek sıcaklık ve basınçlarda gerçekleştirilebilir.
Sodyum bisülfitin sodyum hidroksit ile reaksiyonu Na2SO3’ü sentezleyebilir. Bu reaksiyon, yan ürünler olarak Na2SO3, su ve sodyum klorür üretir.
Başka bir yöntem, Na2SO3 ve hidrojen sülfür gazı üretmek için sodyum sülfürün su varlığında sülfür dioksit gazıyla reaksiyona sokulmasını içerir.
Na2SO3’ü sentezlemek için sodyum sülfatın , aktif karbon gibi bir indirgeyici maddenin varlığında kükürt dioksit gazı ile işlenmesi gerekir. Bu reaksiyon Na2SO3 ve karbondioksit üretir.
Bu yöntemlerin her birinin kendi avantajları ve dezavantajları vardır ve yöntemin seçimi, istenen verim, ürünün saflığı ve maliyeti ile reaktiflerin ve ekipmanın bulunabilirliği gibi çeşitli faktörlere bağlıdır.
Sodyum sülfitin kullanım alanları
Na2SO3’ün aşağıdakiler de dahil olmak üzere birçok önemli endüstriyel ve ticari kullanımı vardır:
- Fotoğrafçılık: Fotoğrafik geliştirme çözümlerinde indirgeyici madde ve koruyucu olarak kullanılır. Bu, görüntünün sabitlenmesine ve solmanın önlenmesine yardımcı olur.
- Su Arıtma: Endüstriyel ve belediye su arıtma tesislerinde sudaki klor ve fazla oksijenin uzaklaştırılmasında kullanılır. Ayrıca boruların ve ekipmanların korozyonunu önlemeye yardımcı olur.
- Kağıt ve kağıt hamuru endüstrisi: kağıt ve kağıt hamuru üretiminde kağıt hamurunun lignin içeriğini beyazlatmak ve azaltmak için kullanılır. Bu, kağıdın kalitesini ve rengini iyileştirmeye yardımcı olur.
- Gıda sektörü: Gıda sektöründe koruyucu ve antioksidan olarak kullanılır. Kurutulmuş meyve, şarap ve bira gibi gıdaların renk solmasını ve bozulmasını önlemeye yardımcı olur.
- Tekstil Endüstrisi: Tekstil endüstrisinde fazla boyayı gidermek ve kumaşların renk haslığını arttırmak için indirgeyici madde ve ağartma maddesi olarak kullanılır.
- Kimya endüstrisi: Boyaların, farmasötiklerin ve polimerlerin üretiminde olduğu gibi çeşitli kimyasal reaksiyonlarda indirgeyici madde olarak kullanılır.
- Diğer kullanım alanları: Deterjan, deri ürünleri ve saç boyası, şampuan gibi kişisel bakım ürünlerinin imalatında da kullanılır.
Sorular:
S: Kazandaki normal sodyum sülfit nedir?
C: Bir kazandaki normal Na2SO3 konsantrasyonu, çalışma basıncına ve diğer faktörlere bağlı olarak genellikle milyonda 20 ila 40 parça (ppm) arasındadır.
S: Sodyum sülfit ve su oluşturmak için kükürt dioksiti sodyum hidroksit ile nasıl dengelersiniz?
C: Kükürt dioksit ve sodyum hidroksitin Na2SO3 ve su oluşturacak şekilde reaksiyonuna ilişkin denklemi dengelemek için, denklemin iki tarafında her elementin eşit sayıda atomunun bulunduğundan emin olmalısınız. Dengeli denklem SO2 + 2NaOH → Na2SO3 + H2O olacaktır.
Soru: Sodyum sülfit nedir?
C: Na2SO3, fotoğrafçılık, su arıtma, kağıt üretimi ve gıda muhafazası gibi çeşitli endüstriyel ve ticari uygulamalarda yaygın olarak kullanılan beyaz kristalli bir bileşiktir.
Soru: Sodyum sülfitin formülü nedir?
Cevap: Sodyum sülfitin formülü Na2SO3’tür.
S: Sodyum sülfit bazlı mı?
C: Na2SO3 güçlü bir bazın (sodyum hidroksit) ve zayıf bir asidin (sülfürlü asit) tuzudur ve bu nedenle bazik özelliklere sahiptir. Ancak genellikle sağlam bir temel olarak kabul edilmez.
Soru: Sodyum sülfit suda stabil midir?
C: Na2SO3 suda nispeten stabildir, ancak özellikle oksijen veya diğer oksitleyici maddelerin varlığında zamanla yavaş yavaş ayrışabilir.
Soru: Sodyum sülfit yanıcı mıdır?
C: Na2SO3 yanıcı değildir ancak bazı oksitleyici maddelerle reaksiyona girerek solunumu tahriş eden ve yanıcı olabilen kükürt dioksit açığa çıkarabilir.
S: Sodyum sülfit yerel olarak nereden satın alınır?
C: Na2SO3 kimyasal tedarik şirketlerinden, endüstriyel tedarikçilerden ve bazı özel perakendecilerden satın alınabilir. Ayrıca bazı yerel donanım mağazalarında veya ev geliştirme merkezlerinde de mevcut olabilir.
Soru: Hangi gıdalar sodyum sülfit içerir?
C: Na2SO3 genellikle şarap, bira, kurutulmuş meyveler ve bazı işlenmiş etler gibi gıdalarda koruyucu olarak kullanılır.
S: Hangi ürün sodyum sülfite eşittir?
C: Sodyum bisülfit, bazı uygulamalarda Na2SO3’ün yerine kullanılabilen benzer bir bileşiktir. Diğer ikameler arasında sodyum metabisülfit veya potasyum metabisülfit yer alabilir.
