Sodyum sülfat, Na2SO4 formülüne sahip beyaz kristalli bir bileşiktir. Deterjan, kağıt yapımı ve cam yapımı endüstrilerinde dolgu maddesi, kurutma maddesi ve köpük giderici olarak kullanılır.
| IUPAC Adı | Disodyum sülfat |
| Moleküler formül | Na2SO4 |
| CAS numarası | 7757-82-6 |
| Eş anlamlı | Disodyum sülfat, sodyum sülfat susuz, sodyum sülfat |
| InChI | InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Na2So4 Molar Kütle
Sodyum sülfatın molar kütlesi 142,04 g/mol’dür. İki sodyum katyonu (Na+) ve bir sülfat anyonundan (SO42-) oluşan iyonik bir bileşiktir. Molar kütle, bir sodyum sülfat molekülündeki tüm atomların atomik kütlelerinin toplanmasıyla hesaplanır. Bu durumda elimizde her biri 22,99 g/mol kütleli iki sodyum atomu, 32,06 g/mol kütleli bir kükürt atomu ve her biri 15,99 g/mol kütleli dört oksijen atomu var. Bunları bir araya getirmek bize sodyum sülfatın molar kütlesini verir.
Sodyum sülfatın kaynama noktası
Sodyum sülfatın kaynama noktası 1.429 °C’dir (2.604 °F). Bunun nedeni, pozitif yüklü sodyum iyonları ile negatif yüklü sülfat iyonları arasında güçlü elektrostatik çekim kuvvetleri oluşturan bileşiğin iyonik doğasından kaynaklanmaktadır. Bu kuvvetlerin üstesinden gelmek büyük miktarda enerji gerektirir; sodyum sülfatın kaynama noktasının bu kadar yüksek olmasının nedeni budur.
Sodyum sülfatın erime noktası
Sodyum sülfatın erime noktası su içeriğine bağlı olarak değişir. Susuz sodyum sülfatın (susuz) erime noktası 884°C’dir (1,623°F). Bununla birlikte, sodyum sülfat dekahidrat (on su molekülü ile) 32,4°C (90,3°F) gibi daha düşük bir sıcaklıkta erir. Sodyum sülfat dekahidratın kristal yapısında su moleküllerinin varlığı, sodyum ve sülfat iyonları arasındaki iyonik bağları zayıflatarak erime noktasını düşürür.
Sodyum sülfatın yoğunluğu g/ml
Sodyum sülfatın yoğunluğu formuna bağlı olarak değişir. Sodyum sülfat susuzun yoğunluğu 2,664 g/cm3, sodyum sülfat dekahidratın yoğunluğu ise 1,464 g/cm3’tür. Yoğunluk farkı, dekahidratın kristal yapısında hacmini artıran ve yoğunluğunu azaltan su moleküllerinin varlığından kaynaklanmaktadır.
Sodyum Sülfat Molekül Ağırlığı
Sodyum sülfatın moleküler ağırlığı 142.04 g/mol’dür. Bu, iki sodyum iyonu ve bir sülfat iyonundan oluşan bir sodyum sülfat molekülünün kütlesidir.
Sodyum sülfatın yapısı
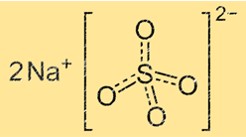
Sodyum sülfat, tekrarlanan sodyum ve sülfat iyon birimlerinden oluşan bir kristal yapıya sahiptir. Sülfat iyonu, köşelerinde dört oksijen atomu ve merkezinde bir kükürt atomu bulunan bir tetrahedrondur. Sodyum iyonu, sülfat iyonları arasında yer alan küçük bir küredir. Sodyum sülfatın kristal yapısı su içeriğine bağlı olarak değişebilir. Susuz sodyum sülfat, sodyum sülfat dekahidrattan farklı bir kristal yapıya sahiptir.
Sodyum sülfat formülü
Sodyum sülfatın kimyasal formülü Na2SO4’tür. Bu, her bir sodyum sülfat molekülünün iki sodyum iyonu (Na+) ve bir sülfat iyonu (SO42-) içerdiği anlamına gelir. Formül, bileşiğin bir molekülündeki atomların en basit tamsayı oranını temsil eder.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 2.664 g/cm3 (susuz), 1.464 g/cm3 (dekahidrat) |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 142,04 gr/mol |
| Yoğunluk | 2.664 g/cm3 (susuz), 1.464 g/cm3 (dekahidrat) |
| Füzyon noktası | 884°C (susuz), 32,4°C (dekahidrat) |
| Kaynama noktası | 1.429°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 44,1 g/100 mL (susuz), 47,6 g/100 mL (dekahidrat) |
| çözünürlük | Suda çözünür, etanolde çözünmez |
| Buhar basıncı | 20°C’de 0,01 mmHg |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 1.: 2.01, 2.: 7.20, 3.: 9.41 |
| pH | 9-11 (%10 çözüm) |
Sodyum sülfatın güvenliği ve tehlikeleri
Sodyum sülfatın kullanımı genellikle güvenli kabul edilir ancak bazı durumlarda tahrişe veya hasara neden olabilir. Temas veya solunması halinde cildi, gözleri ve solunum sistemini tahriş edebilir. Büyük miktarlarda yutulması bulantı, kusma ve ishale neden olabilir. Su yollarına salınması durumunda sudaki yaşam için de zararlı olabilir. Sodyum sülfat yanıcı veya patlayıcı bir madde olarak kabul edilmez. Ancak ısıtıldığında veya yüksek sıcaklıklara maruz bırakıldığında zehirli dumanlar açığa çıkabilir. Uygun kullanım prosedürlerini takip etmek, koruyucu ekipman giymek ve sodyum sülfatı güvenli ve emniyetli bir yerde saklamak önemlidir.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | S24/25: Cilt ve gözlerle temasından kaçının. S36/37: Uygun koruyucu kıyafet ve eldiven kullanın. |
| BM kimlik numaraları | BM 2118 |
| HS kodu | 2833.11.00 |
| Tehlike sınıfı | Tehlikeli değil |
| Paketleme grubu | Uygulanamaz |
| Toksisite | LD50 (oral, sıçan): 5.900 mg/kg |
Sodyum sülfat sentezi için yöntemler
Sodyum sülfatın sentezlenmesi için, sodyum klorürün sülfürik asit ile reaksiyona sokulması veya sodyum hidroksitin sülfürik asit ile reaksiyona sokulması dahil olmak üzere farklı yöntemler vardır.
Sodyum sülfat üretmek için, sodyum klorür ve sülfürik asidin reaksiyonu, sodyum sülfat ve hidrojen klorür gazı üretir. Proses, ekzotermik reaksiyonu kontrollü koşullar altında gerçekleştirerek zararlı dumanları en aza indirir. Daha sonra çözelti, sodyum sülfat kristalleri üretmek üzere buharlaştırılmadan önce filtrasyona tabi tutulur.
Sodyum sülfatın sentezi aynı zamanda sülfürik asit ve sodyum hidroksitin birleştirilerek sodyum sülfat ve su oluşturulmasını da içerir. Reaksiyon ekzotermiktir ve taşmayı önlemek için dikkatli işlem gerektirir. Karışımın filtrelenmesinden sonra elde edilen çözelti buharlaştırmaya tabi tutularak sodyum sülfat kristalleri elde edilir.
Başka bir yöntem, sodyum karbonatın sülfürik asitle reaksiyona sokularak sodyum sülfat, su ve karbon dioksit üretilmesini içerir. Bu yöntem zehirli dumanların salınması nedeniyle çeker ocak kullanılmasını gerektirir. Daha sonra çözelti süzülür ve buharlaştırılarak sodyum sülfat kristalleri elde edilir.
Rayon, deterjan ve cam üretimi gibi diğer endüstriyel işlemler de yan ürün olarak sodyum sülfat üretir. Bu işlemler, atık olarak arıtılabilen ve başka amaçlarla yeniden kullanılabilen sodyum sülfat üretir.
Sodyum sülfatın kullanım alanları
Sodyum sülfatın çeşitli endüstrilerde geniş bir kullanım alanı vardır:
- Deterjanlar: Toz deterjanlarda dolgu maddesi olarak kullanılır, hacmin artmasına ve ürün akışının iyileştirilmesine yardımcı olur.
- Cam: Cam üretiminde eritken olarak kullanılır, erime noktasının düşürülmesine ve nihai ürünün berraklığının arttırılmasına yardımcı olur.
- Tekstil: Malzemenin mukavemetini ve dayanıklılığını arttırmak için suni ipek gibi sentetik elyafların üretiminde kullanılır.
- Kağıt: Kağıt üretiminde kağıt hamuru maddesi olarak kullanılır, ağaç liflerinin parçalanmasına ve yabancı maddelerin giderilmesine yardımcı olur.
- Gıda: Gıda katkı maddesi olarak, özellikle işlenmiş gıdalarda koyulaştırıcı ve emülgatör olarak kullanılır.
- İlaçlar: Kabızlığın tedavisine yardımcı olmak için müshil gibi bazı ilaçların üretiminde kullanılır.
- Kimyasallar: Sodyum sülfit, sodyum silikat ve sodyum bikarbonat dahil olmak üzere çeşitli kimyasalların üretiminde kullanılır.
- Su Arıtma: Su arıtma tesislerinde sert sulardan kalsiyum ve magnezyum iyonlarının uzaklaştırılması amacıyla kullanılır.
- Petrol sondajı: Petrol sondajında ağırlıklandırma maddesi olarak kullanılır ve sondaj sıvısının yoğunluğunun kontrol edilmesine yardımcı olur.
Sorular:
Soru: Sodyum sülfatın formülü nedir?
Cevap: Sodyum sülfatın kimyasal formülü Na2SO4’tür.
S: Sodyum sülfat nedir?
C: Sodyum sülfat, deterjanlar, cam, tekstil, kağıt ve gıda dahil olmak üzere çeşitli endüstriyel uygulamalarda yaygın olarak kullanılan beyaz kristalli bir katıdır.
Soru: Sodyum sülfat asidik mi yoksa bazik mi?
C: Sodyum sülfat ne asidik ne de baziktir; nötr bir bileşiktir.
Soru: Sodyum sülfat ne renktir? C: Sodyum sülfat beyaz kristal bir katıdır ve bu nedenle renksizdir.
