Sodyum metabisülfit (Na2S2O5), yiyecek ve içeceklerde koruyucu ve antioksidan olarak kullanılan kimyasal bir bileşiktir. Ayrıca çeşitli endüstrilerde dezenfektan ve ağartma maddesi olarak da kullanılabilir.
| IUPAC Adı | Sodyum pirosülfit |
| Moleküler formül | Na2S2O5 |
| CAS numarası | 7681-57-4 |
| Eş anlamlı | Disodyum disülfit, pirosülfürik asit, disodyum tuzu, sodyum pirosülfit, sodyum disülfit |
| InChI | InChI=1S/2Na.H2O5S2/c;;1-6(2)7(3,4)5/h;(H,1,2)(H,3,4,5)/q2*+1; /p-2 |
Sodyum metabisülfitin özellikleri
Sodyum Metabisülfit Formülü
Sodyum metabisülfitin kimyasal formülü Na2S2O5’tir. İki sodyum iyonu (Na+) ve bir disülfit iyonundan (S2O5-2) oluşur. Bileşik, suda çözünen ve keskin bir koku yayan beyaz veya sarımsı kristal bir tozdur.
Sodyum Metabisülfit Molar Kütlesi
Na2S2O5’in molar kütlesi 190.107 g/mol’dür. Bu değer, bileşikteki elementlerin sodyum için 22,99 g/mol, kükürt için 32,06 g/mol ve oksijen için 15,99 g/mol olan atomik kütlelerinin eklenmesiyle hesaplanır. Molar kütle, bir kimyasal reaksiyon için bir maddenin ne kadarının gerekli olduğunu belirlemeye yardımcı olan önemli bir özelliktir.
Sodyum metabisülfitin kaynama noktası
Na2S2O5’in erime noktası 150°C’dir ancak kaynamadan ayrışır. Bileşik yaklaşık 150°C sıcaklıkta kükürt dioksit (SO2) ve sodyum sülfite (Na2SO3) ayrışır. Bu nedenle Na2S2O5’in kaynama noktası geçerli değildir.
Sodyum metabisülfit Erime noktası
Na2S2O5’in erime noktası 150°C’dir. Bu sıcaklıkta bileşik katıdan sıvıya faz değişimine uğrar. Erime noktası, bir maddenin tanımlanmasına ve karakterize edilmesine yardımcı olan önemli bir fiziksel özelliktir.
Sodyum metabisülfitin yoğunluğu g/mL
Na2S2O5’in yoğunluğu 1,48 g/mL’dir. Suda batan nispeten yoğun bir bileşiktir. Bir maddenin yoğunluğu birim hacim başına kütledir ve belirli bir hacimde bir maddenin ne kadarının bulunduğunu belirlemeye yardımcı olan önemli bir fiziksel özelliktir.
Sodyum Metabisülfit Molekül Ağırlığı
Na2S2O5’in molekül ağırlığı 190.107 g/mol’dür. Bileşikteki tüm atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı, bir kimyasal reaksiyon için gerekli olan madde miktarının hesaplanmasına yardımcı olan önemli bir özelliktir.
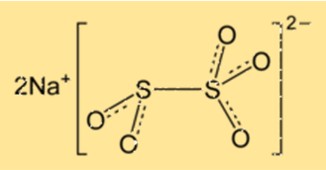
Sodyum metabisülfitin yapısı
Na2S2O5 kristal bir yapıya sahiptir ve ortorombik kristal sistemine aittir. Kristal kafes, tekrarlanan bir düzende düzenlenmiş sodyum iyonları ve disülfit iyonlarından oluşur. Bileşik, kükürt atomlarının tetrahedronun merkezinde olduğu tetrahedral bir moleküler geometriye sahiptir.
Sodyum metabisülfitin çözünürlüğü
Na2S2O5, 25°C’de 54 g/100 mL’lik bir çözünürlükle suda oldukça çözünür. Ayrıca gliserolde çözünür ve etanolde az çözünür. Bir maddenin çözünürlüğü, belirli bir çözücü içinde çözünme yeteneğini belirleyen önemli bir özelliktir.
| Dış görünüş | Beyaz veya sarımsı kristal toz |
| Spesifik yer çekimi | 1.48 |
| Renk | Beyaz ila sarımsı |
| Koku | Dönüm |
| Molar kütle | 190.107 gr/mol |
| Yoğunluk | 1.48g/ml |
| Füzyon noktası | 150°C |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 25°C’de 54 g/100 mL |
| çözünürlük | Gliserolde çözünür ve etanolde az çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | 7.2 |
| pH | 4,5 (%5 çözüm) |
Sodyum Metabisülfitin Güvenliği ve Tehlikeleri
Na2S2O5 uygun şekilde kullanılmazsa tehlikeli olabilir. Maruz kalındığında ciltte, gözlerde ve solunum sisteminde tahrişe neden olabilecek güçlü bir indirgeyici ajandır. Bileşiğin yutulması ciddi gastrointestinal rahatsızlığa neden olabilir. Na2S2O5 serin, kuru ve iyi havalandırılmış bir alanda, uyumsuz malzemelerden uzakta saklanmalıdır. Güçlü asitler, güçlü oksidanlar veya indirgeyici maddelerle karıştırılmamalıdır. Bileşik kullanılırken eldiven, gözlük ve solunum cihazı gibi koruyucu ekipmanlar kullanılmalıdır. Kaza durumunda göz yıkama istasyonları ve yangın söndürücüler gibi acil durum önlemleri hazır bulundurulmalıdır.
| Tehlike sembolleri | Xi (Rahatsız edici) |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının. Koruyucu kıyafet ve eldiven giyin. Yemeyin. Yeterli havalandırmayla kullanın. |
| BM kimlik numaraları | BM 2676 |
| HS kodu | 2832.10.00 |
| Tehlike sınıfı | 8 (Aşındırıcı maddeler) |
| Paketleme grubu | III |
| Toksisite | LD50 (oral, sıçan): 1.000 mg/kg; LC50 (soluma, sıçan): 11 mg/L (4 saat) |
Sodyum metabisülfitin sentezi için yöntemler
Na2S2O5, sodyum bisülfitin hidrojen peroksit gibi bir oksitleyici madde varlığında kükürt dioksit ile reaksiyona sokulması dahil olmak üzere çeşitli yöntemlerle sentezlenebilir. İşlem, Na2S2O5’i oluşturmak için sodyum bisülfit ve kükürt dioksitin katkı maddesini ısıtır.
Başka bir yöntem, sodyum hidroksitin kükürt dioksit gazı ile reaksiyona sokulmasını, ardından sodyum sülfat ve Na2S2O5 oluşturmak üzere sülfürik asit eklenmesini içerir.
Başka bir sentez yöntemi, sodyum karbonatın kükürt dioksit ile reaksiyona sokulmasını ve daha sonra elde edilen sodyum sülfitin hava varlığında ısıtılmasını içerir. Bu işlem sodyum sülfat ve Na2S2O5 üretir.
Hidrojen peroksit veya nitrik asit gibi bir oksitleyici maddenin varlığında, Na2S2O5, kükürtün sodyum sülfit ile reaksiyona sokulmasıyla hazırlanabilir.
Endüstride Na2S2O5’i sentezlemenin en yaygın yöntemi, sodyum bisülfitin manganez dioksit gibi bir katalizör varlığında kükürt dioksitle reaksiyona sokulmasıdır. Sodyum bisülfit/kükürt dioksit eklentisinin ısıtılması Na2S2O5’i oluşturur.
Sodyum metabisülfitin kullanım alanları
Na2S2O5, güçlü indirgeyici özellikleri ve koruyucu ve antioksidan görevi görme yeteneği nedeniyle çeşitli endüstrilerde çeşitli kullanımlara sahiptir. Na2S2O5’in yaygın kullanımlarından bazıları şunlardır:
- Yiyecek ve içecek endüstrisi: Şarap, bira, meyve suları ve kurutulmuş meyveler gibi yiyecek ve içecek ürünlerinde koruyucu ve antioksidan olarak yaygın olarak kullanılmaktadır. Bu, bu ürünlerin bozulmasını ve oksidasyonunu önlemeye yardımcı olur, böylece raf ömrünü uzatır.
- İlaç Endüstrisi: Krem, merhem ve tablet gibi çeşitli farmasötik ürünlerde antioksidan olarak kullanılır. Bu ürünlerin hava ve ışığa maruz kalması nedeniyle bozulmasını önlemeye yardımcı olur.
- Su Arıtma: Su arıtma tesislerinde suyun klorsuzlaştırılmasında kullanılır. Sudaki yaşama zararlı olabilecek aşırı klor ve kloraminlerin ortadan kaldırılmasına yardımcı olur.
- Fotoğrafçılık: Fotoğrafçılık endüstrisinde fotoğraf geliştirici ve sabitleyici olarak kullanılır. Gümüş iyonlarının metalik gümüşe indirgenmesine yardımcı olur, böylece fotoğrafik görüntü oluşur.
- Tekstil endüstrisi: Tekstil endüstrisinde boyama ve baskı proseslerinde indirgeyici madde olarak kullanılır. Boya çözeltisindeki fazla oksijenin uzaklaştırılmasına yardımcı olarak renk yoğunluğunu ve homojenliğini artırır.
Sorular:
S: Sodyum metabisülfiti yerel olarak nereden satın alabilirim?
C: Na2S2O5 genellikle kimya mağazalarında veya çevrimiçi perakendecilerde bulunabilir. Gıda endüstrisinde koruyucu olarak yaygın olarak kullanıldığı için bazı özel gıda mağazalarında da bulunabilmektedir.
S: Sodyum metabisülfit nereden satın alınır?
C: Na2S2O5 kimya mağazalarından veya çevrimiçi özel kimyasal perakendecilerinden satın alınabilir. Ayrıca bazı özel gıda mağazalarında da mevcut olabilir.
S: Sodyum metabisülfit güvenli midir?
C: Na2S2O5 doğru şekilde kullanılmazsa tehlikeli olabilir. Bu bileşiği kullanırken uygun koruyucu ekipman giymek ve güvenlik önlemlerine uymak önemlidir. Ciltte ve gözde tahrişe neden olabilir ve asitle karıştırıldığında toksik kükürt dioksit açığa çıkarabilir. Bununla birlikte, uygun konsantrasyonlarda kullanıldığında ve dikkatli bir şekilde kullanıldığında, Na2S2O5’in amaçlanan kullanımları açısından genellikle güvenli olduğu kabul edilir.
S: Sodyum bisülfatı sodyum metabisülfite dönüştürebilir misiniz?
C: Evet, sodyum bisülfat (NaHSO4), hidrojen peroksit gibi bir oksitleyici maddenin varlığında yüksek sıcaklığa ısıtılarak Na2S2O5’e dönüştürülebilir. Reaksiyon suyun salınmasına ve Na2S2O5 oluşumuna neden olur.
S: Sodyum bisülfit ile sodyum metabisülfit arasındaki fark nedir?
C: NaHSO3 ile Na2S2O5 arasındaki temel fark kimyasal yapılarıdır. Sodyum bisülfitte bir sülfit grubu (-SO3) ve bir hidrojen iyonu (H+) bulunurken, Na2S2O5’te birbirine bağlı iki sülfit grubu (-SO3) bulunur. Na2S2O5 ayrıca sodyum bisülfite göre daha kararlıdır ve daha uzun raf ömrüne sahiptir.
S: Na2S2O5’teki S’nin oksidasyon sayısı nedir?
C: Na2S2O5’teki kükürtün (S) oksidasyon sayısı +5’tir.
S: KIO3 ve Na2S2O5’ten IO3- konsantrasyonu nasıl bulunur?
C: IO3- konsantrasyonu, gösterge olarak nişasta kullanılarak, bilinen bir sodyum tiyosülfat konsantrasyonu (Na2S2O3) ile titrasyon yoluyla belirlenebilir. KIO3 ve Na2S2O5 arasındaki reaksiyon, NaI ve Na2S4O6 oluşturmak üzere Na2S2O3 ile reaksiyona giren iyot (I2) üretir. İyotla reaksiyona girmesi için gereken Na2S2O3 hacmi ölçülerek IO3- konsantrasyonu hesaplanabilir.
S: Na2S2O5 hangi iyonları içerir?
A: Na2S2O5 iki sodyum iyonundan (Na+) ve bir disülfit iyonundan (-S2O5) oluşur.
