Sodyum klorat, NaClO3 formülüne sahip kimyasal bir bileşiktir. Kibrit, boya ve herbisit üretiminde yaygın olarak kullanılan güçlü bir oksitleyici maddedir.
| IUPAC Adı | Sodyum klorat |
| Moleküler formül | NaClO3 |
| CAS numarası | 7775-09-9 |
| Eş anlamlı | Klorik asit, sodyum tuzu; Naclo3; Klorik asit, sodyum tuzu (1:1); UN1495; Sodyum klorat; Sodyum klorit; |
| InChI | InChI=1S/ClH03.Na/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 |
Sodyum kloratın özellikleri
Sodyum Klorat Formülü
Sodyum kloratın kimyasal formülü NaClO3’tür. Bir Na+ iyonu ve bir ClO3- iyonundan oluşan iyonik bir bileşiktir. Na+ iyonu pozitif yüke, ClO3- iyonu ise negatif yüke sahiptir. Formül, bileşiği oluşturmak için bir Na+ iyonunun bir ClO3- iyonuyla birleştirildiğini gösterir.
Sodyum Klorat Molar Kütlesi
NaClO3’ün molar kütlesi 106,44 g/mol’dür. Bu, Avogadro sayısı kadar (6,022 x 10^23) molekül içeren bileşiğin bir molünün kütlesidir. Bileşikteki tüm atomların atom kütlelerinin eklenmesiyle hesaplanır.
Sodyum kloratın kaynama noktası
NaClO3’ün kaynama noktası 300°C’dir (572°F). Bu, bileşiğin sıvıdan gaza dönüştüğü sıcaklıktır. Kaynama noktası, moleküller arasındaki moleküller arası kuvvetlerin kuvveti ile belirlenir.
Sodyum kloratın erime noktası
NaClO3’ün erime noktası 248°C’dir (478°F). Bu, bileşiğin katı halden sıvı duruma geçtiği sıcaklıktır. Erime noktası, moleküller arasındaki moleküller arası kuvvetlerin kuvveti ile belirlenir.
Sodyum kloratın yoğunluğu g/mL
NaClO3’ün yoğunluğu 2,49 g/mL’dir. Birim hacim başına bileşiğin kütlesidir. Yoğunluk maddenin kütlesine ve hacmine göre belirlenir.
Sodyum Klorat Molekül Ağırlığı
NaClO3’ün moleküler ağırlığı 106,44 g/mol’dür. Bileşikteki tüm atomların atom ağırlıklarının toplamıdır.
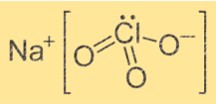
Sodyum kloratın yapısı
NaClO3’ün yapısı kristaldir. Na+ iyonu altı farklı ClO3- iyonundan gelen altı oksijen atomuyla çevrilidir. ClO3- iyonları Na+ iyonunun etrafında tetrahedral bir şekil oluşturur. Yapı, Na+ iyonu ve ClO3- iyonları arasındaki iyonik bağlarla bir arada tutulur.
Sodyum kloratın çözünürlüğü
NaClO3 su, etanol ve metanolde çözünür. Berrak, renksiz bir çözelti oluşturmak için suda kolayca çözünür. NaClO3’ün sudaki çözünürlüğü sıcaklıkla artar. 20°C’de çözünürlük 85 g/100 mL sudur.
| Dış görünüş | Beyaz katı |
| Spesifik yer çekimi | 2,49 gr/cm³ |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 106,44 gr/mol |
| Yoğunluk | 2.49g/ml |
| Füzyon noktası | 248°C (478°F) |
| Kaynama noktası | 300°C (572°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 85g/100ml |
| çözünürlük | Suda, etanolde ve metanolde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Nötr (7) |
Sodyum Kloratın Güvenliği ve Tehlikeleri
NaClO3 güçlü bir oksitleyici maddedir ve dikkatle kullanılmalıdır. Kağıt, ahşap, yağ gibi organik maddelerle teması halinde yangın ve patlama riski bulunmaktadır. Ayrıca indirgeyici maddeler, asitler ve metal tozlarıyla da şiddetli reaksiyona girebilir. NaClO3’ün yutulması veya solunması, solunum sorunları, karın ağrısı ve kusma gibi ciddi sağlık etkilerine neden olabilir. NaClO3 ayrıca cildi, gözleri ve solunum sistemini tahriş edebilir. NaClO3 ile çalışırken maruz kalma ve potansiyel tehlikelerden kaçınmak için eldiven, gözlük ve solunum cihazı dahil uygun koruyucu ekipman giyilmelidir.
| Tehlike sembolleri | Oksitleyici ajan |
| Güvenlik Açıklaması | Yutulması halinde zararlıdır, ciddi göz tahrişine neden olur, solunum yolu tahrişine neden olabilir |
| BM kimlik numaraları | BM 1495 |
| HS kodu | 2829.19.00 |
| Tehlike sınıfı | 5.1 (Oksitleyici malzemeler) |
| Paketleme grubu | II |
| Toksisite | Yutulması veya solunması halinde toksiktir, cildi ve gözleri tahriş eder |
Sodyum kloratın sentezi için yöntemler
NaClO3’ü sentezlemek için çeşitli yöntemler mevcuttur.
Yaygın bir yöntem, bir sodyum klorür çözeltisini elektrolize etmektir. Bu, sodyum klorürün NaClO3 ve klor gazına parçalanmasına neden olan çözeltiden bir elektrik akımının geçirilmesini içerir. Başka bir yöntem, NaClO3 ve sodyum klorür oluşturmak için sodyum hidroksitin klor gazı ile reaksiyona sokulmasını içerir.
Üçüncü bir yöntem, bir katalizör varlığında sodyum karbonatın klor gazı ile reaksiyonunu içerir. Bu NaClO3, sodyum klorür ve karbondioksit üretir. Sodyum hipoklorit ve sodyum hidroksit arasındaki reaksiyon alternatif olarak NaClO3 üretebilir. Bu reaksiyon NaClO3, sodyum klorür ve suyun oluşmasıyla sonuçlanır.
Bu yöntemlerin yanı sıra sodyum kloritin hidrojen peroksit ile reaksiyonu sonucu da NaClO3 üretilebilmektedir. Bu reaksiyon NaClO3, su ve oksijen gazının oluşmasıyla sonuçlanır.
Sodyum kloratın kullanım alanları
NaClO3’ün çeşitli endüstrilerde çeşitli kullanımları vardır. Yaygın kullanımlarından bazıları şunlardır:
- Herbisit: Herbisit olarak, özellikle yol kenarları, demiryolu hatları ve elektrik hatları gibi ekilmemiş alanlardaki yabani otları kontrol etmek için yaygın olarak kullanılır. Bitki fotosentezini bozarak çeşitli yabancı otları etkili bir şekilde kontrol edebilir.
- Ağartıcı: Kağıt hamuru ve kağıt endüstrisinde ağartma maddesi olarak kullanılır. Özellikle yüksek kalitede parlak beyaz kağıt üretiminde etkilidir.
- Madencilik: Madencilik sektöründe altın ve diğer değerli metallerin çıkarılmasında oksitleyici madde olarak kullanılır.
- Patlayıcılar: Dinamit ve amonyum klorat gibi patlayıcıların üretiminde bileşen olarak kullanılır.
- Boyalar ve pigmentler: Boyaların ve pigmentlerin üretiminde, özellikle tekstillerin renklendirilmesinde kullanılır.
- Laboratuvar: Laboratuvarda çeşitli kimyasal reaksiyonlar için reaktif olarak kullanılır.
- Su Arıtma: Su arıtımında yosun oluşumunu kontrol etmek için ve dezenfektan olarak kullanılır.
- Gıda koruyucusu: Ayrıca bazı gıdaların raf ömrünü uzatmak için gıda koruyucusu olarak da kullanılır.
Sorular:
S: Sodyum klorat nasıl yapılır?
A: NaClO3, sodyum klorür çözeltisinin elektrolizi, sodyum hidroksitin klor gazı ile reaksiyonu ve sodyum karbonatın bir katalizör varlığında klor gazı ile reaksiyonu gibi çeşitli yöntemlerle üretilebilir.
S: Sodyum kloratın yabani otları öldürmesi ne kadar sürer?
C: NaClO3 güçlü bir herbisittir ve uygulamadan birkaç gün sonra yabani otları öldürebilir. Yabani otları öldürmek için gereken süre, kullanılan NaClO3 konsantrasyonu ve hedeflenen yabani ot türü gibi faktörlere bağlı olarak değişebilir.
S: Sodyum klorat saf bir madde midir?
C: Evet, NaClO3 saf bir maddedir çünkü sadece sodyum, klor ve oksijen atomlarından oluşan bir bileşiktir.
S: Sodyum klorat suda çözünür mü?
C: Evet, NaClO3 suda oldukça çözünür. Berrak, renksiz bir çözelti oluşturmak için suda çözünebilir.
Soru: Bir sodyum klorat molekülünde kaç tane oksijen atomu vardır?
C: Bir NaClO3 molekülünde üç oksijen atomu bulunur. Kimyasal formülü NaClO3’tür.
S: Sodyum klorat iyonik mi yoksa kovalent mi?
Cevap: NaClO3 iyonik bir bileşiktir. Pozitif yüklü Na+ iyonları ve negatif yüklü NaClO3 iyonları oluşturmak üzere elektronların sodyum atomlarından klor atomlarına aktarılmasıyla oluşur.
