Sodyum etoksit, sodyumun etanol ile reaksiyonu sonucu oluşan güçlü bir bazdır. Esterifikasyon ve deprotonasyon gibi reaksiyonları kolaylaştırmak için organik sentezde kullanılır.
| IUPAC Adı | Sodyum etoksit |
| Moleküler formül | C2H5NaO |
| CAS numarası | 141-52-6 |
| Eş anlamlı | Etanol, sodyum tuzu; Sodyum etoksit; Etil sodyum; Etilat; Sodyum etil alkolat |
| InChI | InChI=1S/C2H5O.Na/c1-2-3;/h2-3H,1H3;/q-1;+1 |
Sodyum etoksitin özellikleri
Sodyum Etoksit Formülü
Sodyum etoksitin kimyasal formülü C2H5NaO’dur. İki karbon atomu (C), beş hidrojen atomu (H), bir sodyum atomu (Na) ve bir oksijen atomundan (O) oluşur. Formül, bir sodyum etoksit molekülünde bulunan atomların oranını temsil eder.
Sodyum Etoksit Molar Kütlesi
Sodyum etoksitin molar kütlesi, formülündeki tüm atomların atomik kütlelerinin eklenmesiyle hesaplanır. Sodyumun (Na) molar kütlesi 22,99 g/mol, karbonun (C) molar kütlesi 12,01 g/mol, hidrojenin (H) molar kütlesi 1,01 g/mol mol ve oksijenin (O) molar kütlesi vardır. kütlesi 1,01 g/mol. kütle 16,00 g/mol. Bunların eklenmesi, sodyum etoksit için yaklaşık 68.06 g/mol’lük bir molar kütle verir.
Sodyum etoksitin kaynama noktası
Sodyum etoksitin kaynama noktası yaklaşık 90-95°C’dir (194-203°F). Bu sıcaklık, standart atmosferik basınç altında ısıtıldığında sodyum etoksitin sıvı fazdan gaz fazına geçtiği noktayı gösterir.
Sodyum etoksitin erime noktası
Sodyum etoksitin erime noktası yaklaşık 260-270°C’dir (500-518°F). Bu, katı sodyum etoksitin sıvı duruma geçtiği sıcaklık anlamına gelir.
Sodyum etoksitin yoğunluğu g/mL
Sodyum etoksitin yoğunluğu yaklaşık 0,868 g/mL’dir. Yoğunluk, bir maddenin birim hacim başına kütlesini ifade eder ve eşit hacimdeki suya kıyasla maddenin göreceli ağırlığını veya hafifliğini belirlemek için kullanılabilir.
Sodyum Etoksit Molekül Ağırlığı
Sodyum etoksitin moleküler ağırlık olarak da adlandırılan moleküler ağırlığı yaklaşık 68,06 g/mol’dür. Bir sodyum etoksit molekülünde bulunan tüm atomların atomik kütlelerinin eklenmesiyle hesaplanır.
Sodyum etoksitin yapısı
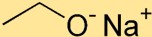
Sodyum etoksit, sodyum atomunun (Na) oksijen atomuna (O) iyonik bir bağ ile bağlandığı bir yapıya sahiptir. İki karbon (C) atomu ve beş hidrojen (H) atomundan oluşan etoksit grubu, sodyum atomuna bağlanır.
Sodyum etoksitin çözünürlüğü
Sodyum etoksit, etanol (C2H5OH) ve diğer organik çözücüler gibi polar çözücülerde oldukça çözünür. Berrak, renksiz bir çözelti oluşturmak için bu çözücülerde kolayca çözünür ve çeşitli organik reaksiyonlarda reaktif olarak kullanılmasını kolaylaştırır.
| Dış görünüş | Renksiz katı |
| Spesifik yer çekimi | 0,868 gr/ml |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 68,06 gr/mol |
| Yoğunluk | 0,868 gr/ml |
| Füzyon noktası | 260-270°C (500-518°F) |
| Kaynama noktası | 90-95°C (194-203°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suyla reaksiyona girer |
| çözünürlük | Etanol (C2H5OH) ve diğer organik çözücülerde çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Müsait değil |
| pH | Temel (alkali) |
Sodyum Etoksitin Güvenliği ve Tehlikeleri
Sodyum etoksit çeşitli güvenlik riskleri taşır ve kullanılırken dikkatli olunmalıdır. Ciltte, gözlerde ve solunum sisteminde ciddi yanıklara neden olabilen aşındırıcı bir maddedir. Doğrudan temastan kaçınılmalı, eldiven, gözlük ve koruyucu kıyafet giyilmelidir. Suyla şiddetli reaksiyona girerek yanıcı hidrojen gazı açığa çıkarır ve nemden uzakta saklanmalıdır. Sodyum etilat ayrıca havayla kuvvetli bir şekilde reaksiyona girerek potansiyel olarak yangına veya patlamaya neden olabilir. Buhar birikimini önlemek için iyi havalandırma çok önemlidir. Ek olarak, riskleri en aza indirmek ve güvenliği sağlamak için sodyum etoksitin iyi donanımlı bir laboratuvarda eğitimli personel ile işlenmesi önemlidir.
| Tehlike sembolleri | Aşındırıcı |
| Güvenlik Açıklaması | – Ciddi yanıklara neden olur<br>- Suyla teması halinde şiddetli reaksiyona girer<br>- Nemden uzakta saklayın<br>- Dikkatli kullanın<br>- Koruyucu ekipman kullanın<br>- Kuru bir yerde saklayın<br>- Şunları sağlayın: iyi havalandırma |
| BM kimlik numaraları | UN2922 |
| HS kodu | 2905.19.00 |
| Tehlike sınıfı | 8 (Aşındırıcı maddeler) |
| Paketleme grubu | II |
| Toksisite | Yutulması veya solunması halinde toksiktir |
Sodyum etoksit sentezi için yöntemler
Sodyum etoksitin sentezlenmesi için çeşitli yöntemler vardır.
Sodyum etoksiti sentezlemenin bir yolu metalik sodyum ve etanol arasındaki reaksiyonu içerir. Metalik sodyum, susuz etanol ile redoks reaksiyonuna girerek sodyum etoksit oluşumuna neden olur. Reaksiyonu gerçekleştirmek için, mutlak etanole küçük sodyum metal parçaları eklenebilir ve karışım kontrollü koşullar altında geri akıtılabilir.
Başka bir yöntem , sodyum hidroksit (NaOH) ve etanol arasındaki reaksiyonu içerir. Sodyum hidroksit etanol içinde çözülür ve karışım ısıtılır, bu da reaksiyonun sodyum etoksit verecek şekilde desteklenmesini sağlar. Kimyacılar metalik sodyum ile etanol arasındaki doğrudan reaksiyonu tercih etmedikleri zaman bu yöntemi yaygın olarak kullanırlar.
Alternatif olarak etanolü sodyum karbonatla (Na2CO3) reaksiyona sokarak sodyum etoksit hazırlayabilirler. Sodyum karbonatı etanol içerisinde çözün, ardından karışımı ısıtın ve karıştırın. Bu işlem sodyum etoksit oluşumuna yol açar.
Bu sentez yöntemlerinin, ilgili kimyasalların reaktivitesi nedeniyle güvenlik önlemlerine sıkı sıkıya bağlı kalmayı gerektirdiğine dikkat edilmelidir. Yanıcı maddelerin uygun şekilde kullanılması, koruyucu ekipman kullanımı ve reaksiyonların iyi havalandırılan alanlarda yürütülmesi, personel güvenliği ve başarılı sodyum etoksit sentezi için çok önemlidir.
Sodyum Etoksitin Kullanım Alanları
Sodyum etoksit, reaktifliği ve güçlü bazik yapısı nedeniyle çeşitli uygulamalar bulur. İşte bazı yaygın kullanımlar:
- Organik Sentez: Sodyum etoksit, organik sentezde yaygın olarak katı bir baz olarak hizmet eder. Esterleşme, yoğunlaşma ve proton giderme işlemleri gibi reaksiyonları kolaylaştırır.
- Alkoksit Reaktifi: Çeşitli organik bileşiklerle reaksiyona girerek alkoksitler oluşturabilen bir alkoksit reaktifi görevi görür. Bu alkoksitler birçok organik reaksiyonda önemli ara maddelerdir.
- Katalizör: Sodyum etoksit, çeşitli kimyasal reaksiyonlarda katalizör görevi görür. Alkoller ve esterler gibi organik bileşiklerin karşılık gelen eterlere veya esterleşme ürünlerine dönüştürülmesini destekler.
- Dehidrasyon maddesi: Su moleküllerini uzaklaştırarak organik bileşikleri dehidre eder, böylece susuz ürünlerin sentezini kolaylaştırır.
- Polimerizasyon: Sodyum etoksit, polietilen tereftalat (PET) ve diğer polyester polimerlerin üretimi de dahil olmak üzere polimerizasyon reaksiyonlarına katılır.
- Farmasötik üretim: Esterler, eterler ve ara ürünler dahil olmak üzere çeşitli farmasötik bileşiklerin sentezi için farmasötik endüstrisinde uygulama alanı bulur.
- Biyodizel Üretimi: Transesterifikasyon işlemi, bitkisel yağları veya hayvansal yağları yenilenebilir ve çevre dostu bir yakıt olan biyodizele dönüştürmek için sodyum etilat kullanır.
- Laboratuvar Reaktifi: Araştırmacılar genellikle organik reaksiyonlar için ve deney düzeneklerinde bir reaktif olarak sodyum etoksit kullanırlar.
Sorular:
S: Sodyum etoksit bazlı mı?
C: Evet, sodyum etoksit bir bazdır.
S: Sodyum etoksit güçlü veya zayıf bir baz mıdır?
C: Sodyum etoksit güçlü bir bazdır.
S: Suya sodyum etoksit eklenirse ne beklersiniz?
C: Suya sodyum etoksit eklenirse kuvvetli bir şekilde reaksiyona girer, hidrojen gazı açığa çıkar ve sodyum hidroksit oluşur.
S: Sodyum etoksit güçlü veya zayıf bir baz mıdır?
C: Sodyum etoksit güçlü bir bazdır.
S: Sodyum etoksit güçlü bir nükleofil midir?
C: Evet, sodyum etoksit güçlü bir nükleofildir.
Soru: Aşağıdakilerden hangisi sodyum etoksit ile E2 reaksiyonuna en kolay şekilde girer?
C: Birincil veya ikincil ayrılan gruba sahip bileşik, sodyum etoksit ile E2 reaksiyonuna daha kolay girer.
S: Sodyum etoksit güçlü bir nükleofil midir?
C: Evet, sodyum etoksit güçlü bir nükleofildir.
S: Sodyum etoksit bazlı mı?
C: Evet, sodyum etoksit bir bazdır.
Soru: Aşağıdakilerden hangisi sodyum etoksit (NaOCH2CH3) ile E2 reaksiyonuna en kolay şekilde girer?
C: Birincil veya ikincil ayrılan gruba sahip bir bileşik, sodyum etoksit ile E2 reaksiyonuna daha kolay girer.
S: Sodyum etoksit yanıcı mıdır?
C: Sodyum etoksitin kendisi yanıcı değildir ancak suyla şiddetli reaksiyona girerek yanıcı hidrojen gazı açığa çıkarır.
S: Etanol ile birleştirildiğinde sodyum etoksit ve hidrojen üreten şey nedir?
C: Sodyum metali ve etanolün kombinasyonu, sodyum etoksit ve hidrojen gazı üretir.
S: Suya sodyum etoksit eklenirse ne beklersiniz?
C: Eğer suya sodyum etoksit eklenirse, kuvvetli bir şekilde reaksiyona girer, hidrojen gazı açığa çıkar ve sodyum hidroksit oluşur.
