Sodyum asetat (C2H3NaO2), Na+ ve C2H3O2- iyonlarından oluşan bir bileşiktir. Yaygın olarak gıda katkı maddesi olarak ve diyaliz solüsyonları gibi tıbbi uygulamalarda ve bazı bakteriler için karbon kaynağı olarak kullanılır.
| IUPAC Adı | Sodyum asetat |
| Moleküler formül | C2H3NaO2 |
| CAS numarası | 127-09-3 |
| Eş anlamlı | Asetik asitin sodyum tuzu, sodyum etanoat, Natriumacetat |
| InChI | InChI=1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
Sodyum asetatın özellikleri
Sodyum Asetat Formülü
Sodyum asetatın kimyasal formülü NaC2H3O2’dir. Bu, bileşiğin bir Na+ iyonu ve bir C2H3O2- iyonundan oluştuğunu gösterir. C2H3O2- iyonu bir karbon atomu, iki oksijen atomu ve üç hidrojen atomundan oluşur. Formül, kimyasal reaksiyonların stokiyometrisini belirlemek ve bileşiğin farklı koşullar altındaki davranışını tahmin etmek için kullanışlıdır.
Sodyum Asetat Molar Kütlesi
NaC2H3O2’nin molar kütlesi 82,03 g/mol’dür. Bu, bir mol NaC2H3O2’nin 82,03 gram ağırlığında olduğu anlamına gelir. Molar kütle, bileşikteki her bir elementin atomik kütlelerinin eklenmesiyle hesaplanır. Sodyumun kütlesi 22,99 g/mol, karbonun kütlesi 12,01 g/mol, hidrojenin kütlesi 1,01 g/mol ve oksijenin kütlesi 16,00 g/moldür. NaC2H3O2’nin molar kütlesi, belirli bir numunede mevcut olan bileşiğin miktarının belirlenmesinde faydalıdır.
Sodyum asetatın kaynama noktası
NaC2H3O2’nin kaynama noktası 881°C’dir (1,618°F). Kaynama noktası, bir maddenin sıvı halden gaz haline geçtiği sıcaklıktır. NaC2H3O2’nin yüksek kaynama noktası, sodyum ve asetat iyonları arasındaki güçlü iyonik bağlardan kaynaklanmaktadır. Yüksek sıcaklıklarda bu bağlar kırılır ve bileşik buharlaşır.
Sodyum asetat Erime noktası
NaC2H3O2’nin erime noktası 324°C’dir (615°F). Erime noktası, bir maddenin katı halden sıvı duruma geçtiği sıcaklıktır. NaC2H3O2’nin yüksek erime noktası aynı zamanda sodyum ve asetat iyonları arasındaki güçlü iyonik bağlardan kaynaklanmaktadır. Yüksek sıcaklıklarda bu bağlar zayıflar ve bileşik erir.
Sodyum asetatın yoğunluğu g/mL
NaC2H3O2’nin yoğunluğu 1,45 g/mL’dir. Yoğunluk, bir maddenin birim hacmi başına kütle miktarıdır. NaC2H3O2’nin yüksek yoğunluğu, moleküllerinin kompakt düzenlenmesinden kaynaklanmaktadır. NaC2H3O2’nin yoğunluğu, bir çözeltideki konsantrasyonuna bağlı olarak değişebilir.
Sodyum Asetat Molekül Ağırlığı
NaC2H3O2’nin moleküler ağırlığı 82,03 g/mol’dür. Bileşiğin bir molünün kütlesidir. Molekül ağırlığı, belirli bir numunedeki bileşiğin miktarının belirlenmesinde ve ayrıca kimyasal reaksiyonların stokiyometrisinin hesaplanmasında faydalıdır.
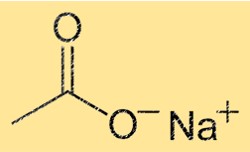
Sodyum asetatın yapısı
NaC2H3O2, tekrarlanan Na(CH3COO) birimine sahip bir kristal yapıya sahiptir. Bu, kristalin her birim hücresinin bir sodyum iyonu ve bir asetat iyonu içerdiği anlamına gelir. Na+ iyonu altı oksijen atomuyla çevrelenirken, C2H3O2- iyonu bir karbon atomu, iki oksijen atomu ve üç hidrojen atomundan oluşur. İyonlar arasındaki güçlü iyonik bağlar kristale stabilitesini ve yüksek erime ve kaynama noktalarını verir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 20°C’de 1,45 |
| Renk | Renksiz veya beyaz |
| Koku | Kokusuz |
| Molar kütle | 82,03 g/mol |
| Yoğunluk | 20°C’de 1,45 g/cm³ |
| Füzyon noktası | 324°C (615°F) |
| Kaynama noktası | 881°C (1618°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 820 g/L (20°C) |
| çözünürlük | Suda, etanolde, asetonda çözünür |
| Buhar basıncı | 239,2°C’de 1 mm Hg |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 4,76 (25°C’de) |
| pH | 7 (%1 çözüm) |
Sodyum Asetatın Güvenliği ve Tehlikeleri
NaC2H3O2’nin genellikle uygun önlemler alındığında taşınması ve kullanılması güvenli kabul edilir. Ancak ciltte ve gözlerde tahrişe neden olabilir ve büyük miktarlarda yutulması veya solunması mide-bağırsak tahrişine, solunum problemlerine ve merkezi sinir sistemi depresyonuna neden olabilir. NaC2H3O2 ayrıca güçlü oksitleyici maddelerle, asitlerle ve alkalilerle reaksiyona girerek ısı ve tehlikeli gazlar oluşturabilir. NaC2H3O2 ile çalışırken eldiven ve göz koruması da dahil olmak üzere uygun kişisel koruyucu ekipmanın kullanılması önemlidir. NaC2H3O2 serin, kuru ve iyi havalandırılmış bir alanda, uyumsuz maddelerden uzakta saklanmalıdır. Kazara maruz kalma veya yutulma durumunda derhal tıbbi yardıma başvurun.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının. Yutmayın veya solumayın. İyi havalandırılmış alanlarda kullanın. |
| BM kimlik numaraları | Düzenlenmemiş |
| HS kodu | 2915.21.00 |
| Tehlike sınıfı | sınıflandırılmamış |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük toksisite |
Sodyum asetatın sentezi için yöntemler
NaC2H3O2’yi sentezlemek için çeşitli yöntemler vardır, ancak en yaygın olanı asetik asit ve sodyum hidroksitin nötralizasyon reaksiyonunu içerir. Reaksiyon denklemi aşağıdaki gibidir:
CH3COOH + NaOH → CH3COONa + H2O
Reaksiyonu gerçekleştirmek için öncelikle buzlu asetik asitin su içinde çözülmesiyle bir asetik asit çözeltisi hazırlanır. Karıştırırken, çözeltinin pH’ı yaklaşık 7’ye ulaşana kadar asetik asit çözeltisine yavaş yavaş sodyum hidroksit ekleyin.
Bu noktada çözelti NaC2H3O2 ve su içerecektir. Katı NaC2H3O2 elde etmek için çözelti kuruyana kadar düşük ısıda buharlaştırılabilir. Alternatif olarak çözeltinin oda sıcaklığına kadar soğumasına izin verilebilir ve NaC2H3O2 kristalleri kendi başlarına çökecektir.
NaC2H3O2’yi sentezlemenin başka bir yöntemi, asetik anhidrit ile sodyum karbonat arasında reaksiyona girmeyi içerir. Reaksiyon denklemi aşağıdaki gibidir:
2 (CH3CO)2O + Na2CO3 → 2 CH3COONa + CO2 + CO + H2O
Bu reaksiyon NaC2H3O2, karbondioksit, karbon monoksit ve su üretir.
Reaksiyon karışımının kuruyana kadar buharlaştırılması ve ardından su içinde kristalleştirilmesi, katı formda NaC2H3O2’yi verebilir. Asetik anhidrürün yüksek maliyeti bu yöntemin az kullanılmasını sağlar.
Sodyum Asetatın Kullanım Alanları
NaC2H3O2 birçok endüstriyel ve bilimsel uygulamaya sahip çok yönlü bir kimyasaldır. Yaygın kullanımlarından bazıları şunlardır:
- Tamponlama maddesi: Kimyasal ve biyolojik uygulamalarda yaygın olarak tamponlama maddesi olarak kullanılır. Sabit bir pH’ın korunmasına ve asitlik dalgalanmalarının önlenmesine yardımcı olur.
- Isıtma Paketleri: Isıtma paketleri veya ısıtma yastıklarının üretiminde kullanılır. Bu torbalar küçüktür ve vücudun belirli bir bölgesine ısı sağlamak için ısınabilirler.
- Gıda katkı maddesi: Gıda katkı maddesi olarak, esas olarak lezzet arttırıcı, pH düzenleyici ve koruyucu olarak kullanılır. İşlenmiş gıda üreticileri genellikle bunu atıştırmalıklara, soslara ve et ürünlerine dahil eder.
- Tekstil endüstrisi: Tekstil endüstrisinde boyama ve baskı yardımcı maddesi olarak kullanılır. Kumaşların boya emilimini ve renk haslığını artırmaya yardımcı olur.
- Kimyasal sentez: Çeşitli kimyasal reaksiyonlarda reaktif olarak kullanılır. Alkolleri karşılık gelen alkil halojenürlere dönüştürür ve asetik asitten asetik anhidrit üretir.
- Tıbbi Uygulamalar: Hemodiyaliz gibi tıbbi uygulamalarda ve elektrolit solüsyonlarının bir bileşeni olarak kullanılır.
- Fotoğrafçılık: Fotoğraf baskılarından ve negatiflerden pozlanmamış gümüş halojenürleri çıkarmak için fotoğrafçılıkta sabitleyici bir çözüm olarak kullanılır.
Sorular:
S: Amit sentezinde sodyum asetatın amacı nedir?
A: NaC2H3O2, amid sentezinde başlangıç malzemesinin amin grubunun protonunu gidermek için baz olarak kullanılır. Bu, amid bağını oluşturmak için karboksilik asitle reaksiyonu kolaylaştırır.
S: Amit sentezinde sodyum asetat çözeltisinin amacı nedir?
A: Amit sentezinde bazik katalizör olarak NaC2H3O2 çözeltisi kullanılır. Başlangıç materyalindeki amin grubunun protonsuzlaştırılmasına yardımcı olarak onu karboksilik asit karşısında daha reaktif hale getirir.
S: Sodyum asetat bazlı mı?
C: Evet, NaC2H3O2 bir bazdır. Asetik asidin konjuge bazıdır ve suda çözündüğünde pH’ı 9 civarındadır.
S: Sodyum asetat nedir?
A: NaC2H3O2, NaCH3COO kimyasal formülüne sahip asetik asitin bir sodyum tuzudur. Suda çözünen beyaz, kokusuz ve kristal bir tozdur.
S: Asetofenetidin amid sentezinde sodyum asetat çözeltisinin amacı nedir?
A: Asetofenetidinin amid sentezinde, p-fenetidin ile asetik anhidrit arasındaki reaksiyonu kolaylaştırmak için bazik katalizör olarak NaC2H3O2 çözeltisi kullanılır. P-fenetidinin amin grubunun protonsuzlaştırılmasına ve asetik anhidritin nükleofilik saldırısına karşı aktive edilmesine yardımcı olur. Bu, asetofenetidin oluşumuyla sonuçlanır.
