Potasyum tiyosülfat (K2S2O3), fotoğrafçılıkta indirgeyici madde olarak ve yüzme havuzlarında kloru nötralize etmek için kullanılan kimyasal bir bileşiktir. Beyaz kristal bir görünüme sahiptir ve suda çözünür.
| IUPAC Adı | Potasyum tiyosülfat |
| Moleküler formül | K2S2O3 |
| CAS numarası | 10294-66-3 |
| Eş anlamlı | Potasyum hiposülfit, potasyum tiyosülfat, potasyum tiyosülfat pentahidrat, potasyum tiyosülfat pentahidrat, potasyum sülfürotiyoat, potasyum sülfürotiyoik asit |
| InChI | InChI=1S/2K.H2O3S2/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Potasyum tiyosülfatın özellikleri
Potasyum Tiyosülfat Formülü
Potasyum tiyosülfatın (K2S2O3) kimyasal formülü, bileşikte bulunan atomların sayısını ve türünü gösterir. Formül iki potasyum atomu, iki kükürt atomu ve üç oksijen atomundan oluşur. Potasyum atomları pozitif yüke sahipken, kükürt ve oksijen atomları negatif yüke sahiptir.
Potasyum Tiyosülfat Molar Kütlesi
K2S2O3’ün molar kütlesi 190,33 g/mol’dür. Molar kütle, bir maddenin bir molünün kütlesidir ve kimyasal formüldeki tüm atomların atomik kütlelerinin eklenmesiyle hesaplanır. K2S2O3 durumunda formül iki potasyum atomu, iki kükürt atomu ve üç oksijen atomundan oluşur.
Potasyum tiyosülfatın kaynama noktası
K2S2O3 kaynama noktasına ulaşmadan ayrıştığı için kaynama noktası yoktur. Sıcaklık yaklaşık 100°C’ye ulaştığında ve kükürt dioksit açığa çıktığında ayrışma meydana gelir. Bu nedenle bileşik genellikle yüksek sıcaklık uygulamalarında kullanılmaz.
Potasyum Tiyosülfat Erime Noktası
K2S2O3’ün erime noktası 48,3°C’dir. Bu sıcaklık diğer kimyasal bileşiklerle karşılaştırıldığında nispeten düşüktür. Bu sıcaklığa ısıtıldığında katı K2S2O3 sıvı hale gelecektir.
Potasyum tiyosülfatın yoğunluğu g/mL
K2S2O3’ün yoğunluğu 1,667 g/mL’dir. Yoğunluk, belirli bir hacimde bulunan kütle miktarının bir ölçüsüdür. Bu değer, bir mililitre K2S2O3’ün kütlesinin 1.667 gram olduğu anlamına gelir.
Potasyum Tiyosülfat Molekül Ağırlığı
K2S2O3’ün moleküler ağırlığı 190,33 g/mol’dür. Molekül ağırlığı, bileşikteki tüm atomların atom ağırlıklarının toplamıdır. Genellikle bir maddenin molleri ve gramları arasında dönüşüm yapmak için kullanılır.
Potasyum tiyosülfatın yapısı
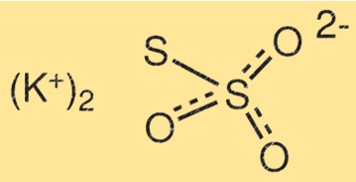
K2S2O3’ün yapısı iki potasyum atomu, iki kükürt atomu ve üç oksijen atomundan oluşur. Kükürt atomları birbirine çift bağla bağlanırken, diğer kükürt atomu oksijen atomlarından birine bağlanır. Potasyum atomları geri kalan oksijen atomlarına bağlanır.
Potasyum tiyosülfatın çözünürlüğü
K2S2O3, 20°C’de 432 g/L çözünürlüğüyle suda oldukça çözünür. Bu onu su arıtımında ve fotografik sabitleme maddesi olarak etkili bir bileşik haline getirir. Ancak etanol veya aseton gibi organik çözücülerde çözünmez.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 1.667 |
| Renk | Renksizden beyaza |
| Koku | Kokusuz |
| Molar kütle | 190,33 gr/mol |
| Yoğunluk | 1.667 g/mL |
| Füzyon noktası | 48,3°C |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çok çözünür (20°C’de 432 g/L) |
| çözünürlük | Organik çözücülerde çözünmez |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | 6,0 – 9,0 (%5 sulu çözelti) |
Potasyum tiyosülfatın güvenliği ve tehlikeleri
Uygun önlemler alındığında K2S2O3’ün taşınması ve kullanılması genellikle güvenli kabul edilir. Ancak bu bileşikle ilgili bazı potansiyel tehlikelerin farkında olmak önemlidir. K2S2O3 tozuna veya buharına maruz kalmak gözlerde, ciltte ve solunum sisteminde tahrişe neden olabilir. Bileşiğin yutulması ayrıca bulantı, kusma ve ishale neden olabilir. Ek olarak bileşikle temas, bazı kişilerde dermatite veya cilt hassasiyetine neden olabilir. Herhangi bir kimyasalda olduğu gibi, K2S2O3 ile çalışırken maruz kalmanın önlenmesi ve kaza riskinin azaltılması için uygun güvenlik protokollerinin takip edilmesi önemlidir.
| Tehlike sembolleri | XI |
| Güvenlik Açıklaması | S22 – Tozu solumayın. S24/25 – Cilt ve gözlerle temasından kaçının. S37/39 – Uygun eldiven ve göz/yüz koruması kullanın. |
| BM kimlik numaraları | BM 3077 |
| HS kodu | 2832.10.00 |
| Tehlike sınıfı | 9 – Çeşitli tehlikeli maddeler |
| Paketleme grubu | III |
| Toksisite | LD50 (oral, sıçan): 2.500 mg/kg |
Potasyum tiyosülfatın sentezi için yöntemler
K2S2O3, bir alkali metal hidroksit varlığında kükürtün potasyum sülfit ile reaksiyonu dahil olmak üzere çeşitli yöntemlerle sentezlenebilir.
Başka bir yöntem, potasyum hidroksitin kükürt ve kükürt dioksit gazı ile reaksiyonunu içerir. Bu reaksiyon, yan ürünler olarak K2S2O3 ve potasyum sülfat üretir.
Alternatif bir sentez yöntemi, potasyum sülfitin sulu bir çözelti içinde sodyum tiyosülfat ile reaksiyonunu içerir. Ortaya çıkan çökelti filtrelenebilir ve saf K2S2O3 elde etmek için yıkanabilir.
Laboratuvarda K2S2O3 hazırlamak için potasyum hidroksit kükürt ile reaksiyona sokulabilir, ardından karışıma kükürt dioksit gazı eklenebilir. Ortaya çıkan ürün, yeniden kristalleştirme yoluyla daha da saflaştırılabilen beyaz kristalli bir katıdır.
Potasyum Tiyosülfatın Kullanım Alanları
K2S2O3’ün çeşitli endüstrilerde birçok önemli kullanımı vardır. İşte en yaygın uygulamalarından bazıları:
- Fotoğrafçılık: Potasyum tiyosülfat, fotoğraf işlemede kullanılmayan gümüş halojenürleri çıkarmak ve görüntü solmasını önlemek için sabitleme maddesi olarak kullanılır.
- Tarım: Potasyum tiyosülfat, bitkilere büyüme ve gelişme için önemli besin maddeleri olan kükürt ve potasyum sağlamak amacıyla gübre olarak kullanılır.
- Su Arıtma: Potasyum tiyosülfat, yüzme havuzu ve spa suyundan klorun uzaklaştırılmasının yanı sıra endüstriyel atık su arıtımında klorun etkilerini nötralize etmek için kullanılır.
- Analitik Kimya: Potasyum tiyosülfat, analitik kimyada iyot ve diğer oksitleyici maddelerin konsantrasyonunu belirlemek için indirgeyici bir madde olarak kullanılır.
- Tıbbi Tedaviler: Potasyum tiyosülfat, siyanür zehirlenmesinin tedavisi gibi bazı tıbbi tedavilerde kullanılmıştır.
- Endüstriyel Uygulamalar: Potasyum tiyosülfat, elektrokaplama, deri tabaklama ve yağ çıkarma gibi çeşitli endüstriyel uygulamalarda kullanılır.
Sorular:
S: Bir şeyin potasyum tiyosülfat indirgeyici madde olup olmadığını nasıl belirlersiniz?
C: K2S2O3 bir indirgeyici maddedir çünkü diğer moleküllere veya iyonlara elektron bağışlayarak oksidasyon durumlarını azaltma yeteneğine sahiptir.
S: Potasyum tiyosülfatı indirgeyici madde yapan nedir?
C: K2S2O3, sülfattan daha düşük oksidasyon durumuna sahip bir kükürt atomuna sahiptir, bu da diğer moleküllere veya iyonlara elektron bağışlamasına ve indirgeyici madde olarak görev yapmasına olanak tanır.
S: Potasyum tiyosülfat yeşil sebzeleri yakar mı?
C: Hayır, K2S2O3 yeşillikleri yakmaz. Beyaz kristal bir katıdır ve yeşil renk göstermez.
S: AgCl’nin 1,0 M K2S2O3’teki molar çözünürlüğü nedir?
C: AgCl’nin 1,0 M K2S2O3 içindeki molar çözünürlüğü sıcaklık ve iyon kuvveti gibi çeşitli faktörlere bağlıdır. Ek bilgi olmadan kesin bir değer belirlenemez.
S: 2’deki (K2S2O3) K’nin yük veya yükseltgenme sayısı nedir?
C: 2’deki (K2S2O3) K’nin yük veya yükseltgenme sayısı +1’dir.
S: K2S2O3’teki S’nin oksidasyon durumu nedir?
C: S’nin K2S2O3’teki oksidasyon durumu +2’dir.
Soru: 4 mol K2S2O3’te kaç molekül vardır?
C: 4 mol K2S2O3’te yaklaşık 4 x 6,022 x 10^23 molekül K2S2O3 bulunur, bu da 2,409 x 10^24 moleküle eşdeğerdir.
Soru: 4 mol K2S2O3 ne kadardır?
C: 4 mol K2S2O3’ün kütlesi, K2S2O3’ün (190,31 g/mol) molar kütlesinin 4 ile çarpılmasıyla hesaplanabilir, bu da 761,24 grama eşittir. Dolayısıyla 4 mol K2S2O3 761,24 grama eşittir.
