Potasyum sülfit (K2SO3), potasyum, kükürt ve oksijenden oluşan kimyasal bir bileşiktir. Gıda endüstrisinde renk bozulmasını ve bozulmayı önlemek için koruyucu olarak yaygın olarak kullanılır.
| IUPAC Adı | Potasyum sülfit |
| Moleküler formül | K2SO3 |
| CAS numarası | 10117-38-1 |
| Eş anlamlı | Dipotasyum sülfit; Sülfürik asidin dipotasyum tuzu; Potasyum sülfonat; Kükürt ve potasyum oksit |
| InChI | InChI=1S/2K.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Potasyum Sülfit
Potasyum Sülfit Formülü
Potasyum sülfit, iki potasyum atomu, bir kükürt atomu ve üç oksijen atomu içerdiğini gösteren K2SO3 kimyasal formülüne sahiptir. Bileşik, potasyum hidroksit (KOH) ile kükürt dioksit (SO2) arasındaki reaksiyonla oluşur. Potasyum sülfit iyonik bir bileşiktir, yani pozitif yüklü potasyum iyonlarından ve negatif yüklü sülfit iyonlarından oluşur. Sülfit iyonunun formülü SO32-‘dir.
Potasyum Sülfit Molar Kütlesi
K2SO3’ün molar kütlesi 158,26 g/mol’dür. Bu, her bir elementin atom kütlelerinin (2 x atom kütlesi K) + atom kütlesi S + (3 x atom kütlesi O) formülüne eklenmesiyle hesaplanır. Bir bileşiğin molar kütlesi önemlidir çünkü belirli bir reaksiyon için gereken bileşik miktarının hesaplanmasına veya bir çözeltinin konsantrasyonunun belirlenmesine yardımcı olur.
Potasyum sülfitin kaynama noktası
K2SO3’ün belirli bir kaynama noktası yoktur çünkü kaynama noktasına ulaşmadan ayrışır. Ancak ısıtıldığında K2SO3 termal bozunmaya uğrayarak potasyum sülfat (K2SO4) ve kükürt dioksit (SO2) oluşturur. Ayrışma sıcaklığı yaklaşık 390°C’dir.
Potasyum Sülfit Erime Noktası
K2SO3’ün erime noktası 350°C civarındadır. Bu sıcaklıkta katı bileşik sıvıya dönüşür. Ancak sıcaklık arttıkça daha önce de belirtildiği gibi K2SO3 ayrışır.
Potasyum sülfitin yoğunluğu g/mL
K2SO3’ün yoğunluğu oda sıcaklığında 2,44 g/mL’dir. Yoğunluk, bir maddenin birim hacim başına kütlesi olarak tanımlanır. K2SO3’ün yüksek yoğunluğu onun nispeten ağır bir bileşik olduğunu gösterir. Bu özellik, bileşiğin çözünürlüğü ve reaktivitesi gibi fiziksel özelliklerinin belirlenmesinde önemlidir.
Potasyum Sülfit Molekül Ağırlığı
K2SO3’ün moleküler ağırlığı 158,26 g/mol’dür. Bu değer bileşiğin bir molekülünün ortalama kütlesini temsil eder. Molekül ağırlığı, belirli bir hacim veya kütledeki bir maddenin miktarını hesaplamak için önemlidir; bu, kimyasal reaksiyonlarda ve laboratuvar deneylerinde faydalıdır.
Potasyum sülfitin yapısı
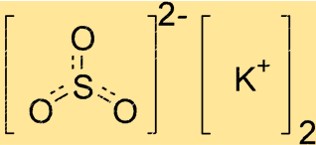
K2SO3 kristal bir yapıya sahiptir, yani atomları tekrar eden bir düzende düzenlenmiştir. Bileşik, merkezde kükürt atomu ve çevresinde simetrik olarak düzenlenmiş üç oksijen atomu ile trigonal düzlemsel bir geometriye sahiptir. Potasyum iyonları bu yapının dışında yer alır ve sülfit iyonlarının negatif yükünü dengeler.
Potasyum sülfitin çözünürlüğü
K2SO3 suda oldukça çözünür. Oda sıcaklığında berrak, renksiz bir çözelti oluşturmak üzere suda çözülebilir. K2SO3’ün çözünürlüğü, sudaki kendisini oluşturan iyonlara ayrışmasını sağlayan iyonik doğasından kaynaklanmaktadır. K2SO3’ün çözünürlüğü de sıcaklıktan etkilenir ve sıcaklık arttıkça çözünürlük artar.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yer çekimi | 2.44 |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 158,26 gr/mol |
| Yoğunluk | 2,44 gr/ml |
| Füzyon noktası | 350°C |
| Kaynama noktası | 390°C’de ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suda çok çözünür |
| çözünürlük | Etanol ve gliserolde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 10.3 (sülfürlü asit için) |
| pH | ~9 (0,1 M çözüm için) |
Potasyum Sülfit Güvenliği ve Tehlikeleri
Uygun önlemler alınırsa K2SO3’ün taşınması ve kullanılması nispeten güvenlidir. Ancak dikkatli kullanılmadığı takdirde tehlike oluşturabilir. Bileşik vücudun bu kısımlarıyla temas ederse ciltte, gözlerde ve solunum sisteminde tahrişe neden olabilir. K2SO3 yutulması halinde mide-bağırsak sorunlarına da neden olabilir. Ek olarak bileşik, ısıya veya aleve maruz kaldığında potansiyel bir yangın ve patlama tehlikesi oluşturur. Bu nedenle K2SO3 ile çalışırken koruyucu ekipman giymek ve bileşiği ısıdan ve tutuşturucu kaynaklardan uzakta saklamak gibi uygun güvenlik önlemleri alınmalıdır.
| Tehlike sembolleri | Kurukafa ve kırık kemikler |
| Güvenlik Açıklaması | Toksiktir, yutulduğunda zararlıdır, cildi ve gözleri tahriş eder |
| BM kimlik numaraları | BM 2697 |
| HS kodu | 283210 |
| Tehlike sınıfı | 6.1 (Zehirli maddeler) |
| Paketleme grubu | II (Orta tehlike) |
| Toksisite | Ağızdan (LD50): 345 mg/kg (sıçan) |
Potasyum sülfit sentez yöntemleri
K2SO3, potasyum hidroksitin kükürt dioksit veya kükürt ile reaksiyonu, potasyum karbonatın kükürt dioksit ile reaksiyonu ve potasyum bisülfitin hidroksit ile reaksiyonu dahil olmak üzere farklı yöntemlerle sentezlenebilir. potasyum.
Birinci yöntemde, potasyum hidroksit çözeltisi su varlığında kükürt dioksit gazı ile reaksiyona girerek K2SO3 oluşturur. İkinci yöntemde ise potasyum karbonat ve kükürt dioksit karışımı yüksek sıcaklıklara ısıtılarak K2SO3 elde edilir. Üçüncü yöntem, K2SO3 ve su üretmek için potasyum bisülfitin potasyum hidroksit ile karıştırılmasını içerir.
K2SO3’ü sentezlemenin bir başka yaygın yöntemi, kükürt dioksitin, sodyum hidrosülfit veya demir(II) sülfat gibi indirgeyici ajanların varlığında potasyum klorür gibi bir potasyum tuzu ile reaksiyonudur. Bu yöntem genellikle endüstriyel ortamlarda büyük miktarlarda K2SO3 üretmek için kullanılır.
Potasyum Sülfitin Kullanım Alanları
K2SO3 kimyasal özelliklerinden dolayı farklı endüstrilerde çeşitli uygulamalara sahiptir. K2SO3’ün bazı yaygın kullanımları şunlardır:
- Yiyecek ve içecek sanayi: Şarap, kuru meyve, karides gibi gıdaların bozulmasını ve renginin solmasını önlemek amacıyla gıda koruyucu olarak kullanılır.
- Fotoğraf: Filmin daha da gelişmesini önlemek ve görüntüyü kalıcı kılmak için fotografik sabitleme maddesi olarak kullanılır.
- Su Arıtma: Kloru sudan uzaklaştırmak ve atık suyu arıtmak için indirgeyici madde olarak kullanılır.
- Kağıt endüstrisi: Kağıt yapım sürecinde yabancı maddeleri gidermek ve hamuru beyazlatmak için ağartma maddesi olarak kullanılır.
- Tekstil endüstrisi: Kumaşlardaki fazla boyayı uzaklaştırmak ve tekstilleri beyazlatmak için indirgeyici madde olarak kullanılır.
- Kimya endüstrisi: Oksitleyici maddeleri indirgeyici maddelere dönüştürmek için kimyasal reaksiyonlarda indirgeyici madde olarak kullanılır.
- İlaç Endüstrisi: Bazı tıbbi tedavilerde belirli durumların semptomlarını önlemek veya hafifletmek için kullanılır.
Sorular:
Soru: Potasyum sülfitin formülü nedir?
C: Potasyum sülfitin formülü K2SO3’tür.
Soru: Potasyum sülfat bir sülfit midir?
C: Hayır, potasyum sülfat bir sülfit değildir. K2SO4 kimyasal formülüne sahip, potasyum, kükürt ve oksijenden oluşan bir tuzdur.
S: H2SO4, NaOH ile reaksiyona girdiğinde hangi tuz üretilir? K2SO3, Na2SO4, Na2SO3, K2SO4
C: H2SO4, NaOH ile reaksiyona girdiğinde oluşan tuz Na2SO4 olur.
S: 99,6 mg Na2SO3’te kaç tane SO32 iyonu bulunur?
Na2SO3’ün molar kütlesi 126,05 g/mol’dür. C: SO32- iyonlarının sayısını hesaplamak için öncelikle Na2SO3’ün mol sayısını bulmamız gerekir: 99,6 mg / 126,05 g/mol = 0,000789 mol. Na2SO3 molekül başına iki SO32- iyonu içerdiğinden, 0,000789 mol Na2SO3’teki SO32- iyonlarının sayısı 0,000789 mol x 2 = 0,00158 mol’dür. Dolayısıyla 99,6 mg Na2SO3’te 0,00158 mol x 6,022 x 10^23 iyon/mol = 9,52 x 10^20 SO32- iyonu vardır.
Soru: 99,6 mg Na2SO3’te kaç tane sodyum iyonu vardır? Na2SO3’ün molar kütlesi 126,05 g/mol’dür.
C: Sodyum iyonlarının sayısını hesaplamak için öncelikle Na2SO3’ün mol sayısını bulmamız gerekir: 99,6 mg / 126,05 g/mol = 0,000789 mol. Her Na2SO3 molekülü iki sodyum iyonu içerdiğinden 0,000789 mol Na2SO3’teki sodyum iyonu sayısı 0,000789 mol x 2 = 0,00158 mol olur. Dolayısıyla 99,6 mg Na2SO3’te 0,00158 mol x 6,022 x 10^23 iyon/mol = 9,52 x 10^20 sodyum iyonu bulunur.
Soru: Na2SO3’ün kimyasal adı nedir?
C: Na2SO3’ün kimyasal adı sodyum sülfittir.
Soru: Formülü Na2SO3 olan bileşiğin adı nedir?
A: Na2SO3 formülüne sahip bileşiğin adı sodyum sülfittir.
