Potasyum sülfat (K2SO4), potasyum, kükürt ve oksijen içeren bir bileşiktir. Bitkilere gerekli besinleri sağlamak ve toprak kalitesini iyileştirmek için yaygın olarak gübre olarak kullanılır.
| IUPAC Adı | Potasyum sülfat |
| Moleküler formül | K2SO4 |
| CAS numarası | 7778-80-5 |
| Eş anlamlı | Sülfürik asit, dipotasyum tuzu; Dipotasyum sülfat; Arkanit; Sülfürik asit, potasyum tuzu (1:2); potasyum sülfat; sal polychrestum; gizli kopya |
| InChI | InChI=1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Potasyum sülfatın özellikleri
Potasyum sülfat formülü
Potasyum sülfatın kimyasal formülü K2SO4’tür. Bu, her bir potasyum sülfat molekülünün iki potasyum atomu, bir kükürt atomu ve dört oksijen atomu içerdiği anlamına gelir. Potasyum sülfat formülü, bileşiği içeren reaksiyonların stokiyometrisinin belirlenmesinde ve ayrıca belirli bir uygulama için gerekli olan potasyum sülfat miktarının hesaplanmasında faydalıdır.
Potasyum Sülfat Molar Kütlesi
K2SO4’ün molar kütlesi yaklaşık 174.259 g/mol’dür. Bu değer, bileşikteki her bir elementin atomik kütleleri (iki potasyum atomu, bir kükürt atomu ve dört oksijen atomu) eklenerek hesaplanır. Molar kütle, gübre üretimi veya laboratuvar deneyleri gibi belirli bir uygulama için gerekli olan K2SO4 miktarının belirlenmesinde yararlı bir değerdir.
Potasyum sülfatın kaynama noktası
K2SO4’ün kaynama noktası yaklaşık 1.690 °C’dir (3.074 °F). Bu, bileşiğin sıvıdan gaza dönüştüğü sıcaklıktır. K2SO4’ün yüksek kaynama noktası, onu gübre ve endüstriyel kimyasalların üretimi gibi yüksek sıcaklık stabilitesi gerektiren uygulamalar için faydalı kılar.
Potasyum Sülfat Erime Noktası
K2SO4’ün erime noktası yaklaşık 1,069 °C’dir (1,956 °F). Bu, katı bileşiğin sıvı duruma geçtiği sıcaklıktır. K2SO4’ün nispeten yüksek erime noktası, onu cam, seramik ve gübre üretimi gibi yüksek sıcaklıktaki uygulamalar için faydalı kılar.
Potasyum sülfatın yoğunluğu g/mL
K2SO4’ün yoğunluğu oda sıcaklığında yaklaşık 2,66 g/mL’dir. Bu, bir mililitre K2SO4’ün 2,66 gram ağırlığında olduğu anlamına gelir. K2SO4’ün yoğunluğu sıcaklığa ve basınca bağlıdır ve belirli bir uygulama için gereken bileşiğin kütlesini veya hacmini hesaplamak için kullanılabilir.
Potasyum Sülfat Molekül Ağırlığı
K2SO4’ün moleküler ağırlığı 174.259 g/mol’dür. Bu değer, bileşikteki tüm elementlerin atom ağırlıkları toplanarak hesaplanır. Molekül ağırlığı, gübreler veya endüstriyel kimyasallar gibi spesifik uygulamalar için gerekli olan K2SO4 miktarının hesaplanmasında faydalıdır.
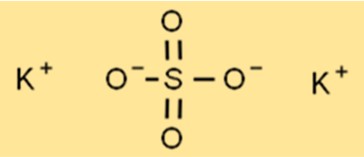
Potasyum sülfatın yapısı
K2SO4’ün yapısı, her bir potasyum iyonunun altı oktahedral şekilli oksijen iyonu ile çevrelendiği bir kristal kafes yapısıdır. Kükürt atomu kafesin merkezinde yer alır ve her bir kükürt atomu dörtgen şeklinde dört oksijen iyonu ile çevrelenir. Bu kafes yapısı K2SO4’e yüksek erime ve kaynama noktaları gibi karakteristik özelliklerini verir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 20°C’de 2,66 |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 174.259 gr/mol |
| Yoğunluk | 20°C’de 2,66 g/cm³ |
| Füzyon noktası | 1069°C (1956°F) |
| Kaynama noktası | 1.690°C (3.074°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 111 g/L |
| çözünürlük | Suda çözünür, etanolde çözünmez |
| Buhar basıncı | 25°C’de 0,0 mmHg |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 1.: 2.17; 2: 07:20; 3.: 11.8 |
| pH | 5,5-8,5 (%1’lik çözüm) |
Potasyum sülfatın güvenliği ve tehlikeleri
K2SO4’ün endüstriyel, tarımsal ve laboratuvar ortamlarında kullanımı genellikle güvenli kabul edilir. Bununla birlikte bileşik, büyük miktarlarda yutulması veya solunması halinde ciltte, gözlerde ve solunum sisteminde tahrişe veya hasara neden olabilir. Ayrıca K2SO4, güçlü asitler gibi bazı kimyasallarla reaksiyona girerek tehlikeli dumanlar veya yangınlar oluşturabilir. K2SO4’ü uygun koruyucu ekipman kullanarak ve güvenlik talimatlarını takip ederek dikkatli bir şekilde kullanmak önemlidir. K2SO4’ün depolanması, uyumsuz malzemelerden uzakta, serin, kuru ve iyi havalandırılan bir alanda olmalıdır.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | S24/25: Cilt ve gözlerle temasından kaçının. |
| BM kimlik numaraları | BM 6066 |
| HS kodu | 3104.30.00 |
| Tehlike sınıfı | Taşıma için tehlikeli değil |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük toksisite |
Potasyum sülfat sentez yöntemleri
K2SO4’ü sentezlemek için çeşitli yöntemler mevcuttur.
Yaygın bir yöntem, potasyum klorürün sülfürik asitle reaksiyonunu içerir. Reaksiyon, yan ürün olarak K2SO4 ve hidrojen klorür üretir.
Başka bir yöntem, potasyum hidroksitin sülfürik asitle reaksiyonunu içerir. Bu reaksiyon aynı zamanda yan ürün olarak K2SO4 ve su üretir.
K2SO4 ayrıca K2SO4, magnezyum sülfat ve sodyum klorür içeren doğal bir mineral olan langbeinit mineralinden de elde edilebilir. Tipik olarak madenciler minerali çıkarır ve safsızlıkları gidermek ve K2SO4’ü ayırmak için onu işler.
K2SO4 üretmenin başka bir yöntemi, potasyum karbonatın sülfürik asitle reaksiyonunu içerir. Bu reaksiyon, yan ürün olarak K2SO4 ve karbondioksit üretir.
Potasyum Sülfatın Kullanım Alanları
K2SO4’ün çeşitli endüstrilerde geniş bir uygulama alanı vardır. K2SO4’ün en yaygın kullanımlarından bazıları şunlardır:
- Gübre: Yüksek potasyum içeriği nedeniyle popüler bir gübre. Meyve, sebze ve diğer mahsullerin yetiştirilmesinde kullanılır.
- Cam endüstrisi: Cam üretiminde flaks olarak kullanılır. Bu, camın erime noktasının düşürülmesine ve dayanıklılığının arttırılmasına yardımcı olur.
- İlaç endüstrisi: Laksatifler ve elektrolit replasman solüsyonları da dahil olmak üzere çeşitli ilaçlarda bileşen olarak kullanılır.
- Gıda endüstrisi: Asitliği düzenlemek için gıda katkı maddesi olarak ve unlu mamullerde ayırıcı madde olarak kullanılır.
- Endüstriyel Uygulamalar: Alüminyum, potasyum karbonat ve diğer kimyasalların üretimi de dahil olmak üzere çeşitli endüstriyel uygulamalarda kullanılır.
- Hayvan Yemi: Hayvancılık ve kümes hayvanlarında sağlıklı büyüme ve gelişmeyi teşvik etmek amacıyla besin takviyesi olarak kullanılır.
- Su Arıtma: Kazanlar ve diğer ekipmanlardaki kireç ve korozyonu kontrol etmek için su arıtımında kullanılır.
Sorular:
S: Potasyum sülfat çözünür mü?
C: Evet, K2SO4 suda çözünür. Oda sıcaklığında yaklaşık 111 g/L çözünürlüğe sahiptir.
S: Stronsiyum bromür ve potasyum sülfat reaksiyona girdiğinde katı ürün ne olacak?
C: Stronsiyum bromür ve K2SO4 reaksiyona girdiğinde oluşan katı ürün, çözünmeyen beyaz bir katı olan stronsiyum sülfattır (SrSO4).
S: Gümüş nitrat ve potasyum sülfatın yer değiştirme reaksiyonunda başka neler üretilir?
C: Gümüş nitrat ve K2SO4’ün yer değiştirme reaksiyonunda gümüş sülfat (Ag2SO4) ve potasyum nitrat (KNO3) da üretilir.
Soru: Potasyum sülfat asit mi yoksa baz mı?
Cevap: K2SO4 ne asit ne de bazdır, tuzdur. Bir asit (sülfürik asit) ile bir baz (potasyum hidroksit) arasındaki nötrleştirme reaksiyonundan oluşur.
S: k2so4 suda çözünür mü?
C: Evet, K2SO4 suda çözünür. Çok çözünür ve çözünürlüğü sıcaklıkla artar.
S: H2so4 naoh ile reaksiyona girdiğinde hangi tuz üretilir? k2so3 na2so4 na2so3 k2so4 A: H2SO4, NaOH ile reaksiyona girdiğinde ortaya çıkan tuz, su ile Na2SO4 (sodyum sülfat) olur.
S: 15,0 g k2so4’te kaç mol k2so4 var?
C: 15,0 g K2SO4’teki K2SO4’ün mol sayısını belirlemek için verilen kütleyi, 174,259 g/mol olan K2SO4’ün molar kütlesine bölmemiz gerekir. Yani 15,0 g’daki K2SO4’ün mol sayısı 0,086 mol’dür.
S: pb(no3)2 (aq) ve k2so4 (aq) karıştırıldığında oluşan çökeltinin formülü ne olurdu?
C: Pb(NO3)2 (sulu) ve K2SO4 (sulu) karıştırıldığında oluşan çökelti, çözünmeyen beyaz bir katı olan PbSO4’tür (kurşun sülfat). Bu reaksiyonun dengeli denklemi Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3’tür.
