Potasyum permanganat (KMnO4), su dezenfeksiyonu, cilt rahatsızlıklarının tedavisi ve laboratuvar reaktifi olarak çeşitli amaçlarla kullanılan mor kristalli bir bileşiktir. Aynı zamanda güçlü bir oksitleyici ajan olarak da kullanılabilir.
| IUPAC Adı | Potasyum permanganat |
| Moleküler formül | KMnO4 |
| CAS numarası | 7722-64-7 |
| Eş anlamlı | Potas permanganat, Condy kristalleri, bukalemun minerali, hipermangan, Kalium hypermanganicum |
| InChI | InChI=1S/K.Mn.4O/q+1;;;;-1 |
Potasyum permanganatın özellikleri
Potasyum permanganat formülü
Potasyum permanganatın kimyasal formülü KMnO4’tür. Bir potasyum iyonu (K+), bir manganez iyonu (MnO4^-) ve dört oksijen atomundan (O) oluşur. Formül, bileşiği oluşturan atomların türünü ve sayısını gösterir. Kimyasal denklemler yazmak ve belirli miktarda maddede bulunan atomların kütlesini ve sayısını hesaplamak için kullanılır.
Potasyum Permanganat Molar Kütlesi
KMnO4’ün molar kütlesi 158.034 g/mol’dür. Bu, 6.022 x 10^23 moleküle eşdeğer olan 1 mol KMnO4’ün kütlesinin 158.034 gram olduğu anlamına gelir. Bir bileşiğin molar kütlesi, bileşikte bulunan tüm elementlerin atomik kütlelerinin toplanmasıyla hesaplanır. KMnO4 durumunda molar kütle, potasyum, manganez ve oksijenin atom kütlelerinin eklenmesiyle hesaplanır.
Potasyum permanganatın kaynama noktası
KMnO4’ün tanımlanmış bir kaynama noktası yoktur çünkü kaynama noktasına ulaşmadan ayrışır. Atmosfer basıncında KMnO4 240°C civarında ayrışmaya başlar. Isıtıldığında önce oksijeni serbest bırakır ve potasyum manganat oluşturur, bu da daha sonra potasyum oksit ve manganez okside ayrışır.
Potasyum Permanganat Erime Noktası
KMnO4’ün erime noktası 240°C’dir. Bu, 240°C’nin altındaki sıcaklıklarda KMnO4’ün katı halde bulunacağı anlamına gelir. KMnO4 ısıtıldığında, oksijen salınımı ve farklı manganez oksitlerin oluşumu da dahil olmak üzere bir dizi kimyasal değişikliğe uğrar.
Potasyum permanganatın yoğunluğu g/ml
KMnO4’ün yoğunluğu oda sıcaklığında 2,703 g/mL’dir. Bu, bir mililitre KMnO4’ün 2,703 gram ağırlığında olduğu anlamına gelir. Bir maddenin yoğunluğu, kütlesinin hacmine oranıdır. KMnO4 söz konusu olduğunda yüksek yoğunluğu, onu diğer maddelerden filtreleme yoluyla ayırmada faydalı kılar.
Potasyum Permanganat Molekül Ağırlığı
KMnO4’ün moleküler ağırlığı 158.034 g/mol’dür. Bu değer bir KMnO4 molekülünün ortalama kütlesini temsil eder. Bileşiği oluşturan potasyum, manganez ve oksijenin atomik kütlelerinin eklenmesiyle hesaplanır.
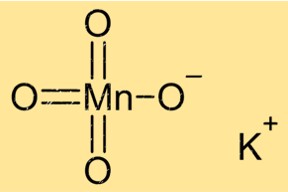
Potasyum permanganatın yapısı
KMnO4 monoklinik kristal sistemine sahip bir kristal yapıya sahiptir. Kristalleri mor renkte olup prizmatik bir şekle sahiptir. Bileşik, merkezi manganez atomunu çevreleyen altı oksijen atomu ile oktahedral bir koordinasyon geometrisine sahiptir. Potasyum iyonları manganez ve oksijen atomlarının katmanları arasında bulunur.
| Dış görünüş | Koyu mor kristal katı |
| Spesifik yer çekimi | 2.703 g/cm³ |
| Renk | Koyu mor |
| Koku | Kokusuz |
| Molar kütle | 158.034 gr/mol |
| Yoğunluk | 2.703 g/cm³ |
| Füzyon noktası | 240°C |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 6,38 g/L |
| çözünürlük | Suda, etanolde, asetonda çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 2.17 |
| pH | 7,2 – 8,9 (%1 çözüm) |
Potasyum permanganatın güvenliği ve tehlikeleri
KMnO4 doğru şekilde kullanılmazsa tehlikeli olabilir. İndirgeyici maddelerle, organik bileşiklerle ve diğer kimyasallarla şiddetli reaksiyona girebilen güçlü bir oksitleyici maddedir. Ciltte ve gözlerde tahrişe neden olabilir ve yutulması veya solunması halinde zararlı olabilir. Bileşik ayrıca ciltte ve giysilerde leke bırakabilir. KMnO4’ü kullanırken koruyucu kıyafet, gözlük ve eldiven giymek de dahil olmak üzere uygun güvenlik önlemleri alınmalıdır. Uyumsuz malzemelerden uzakta, serin, kuru, iyi havalandırılmış bir alanda saklanmalıdır. Maruz kalınması veya yutulması halinde derhal tıbbi yardıma başvurun.
| Tehlike sembolleri | O, Xn |
| Güvenlik Açıklaması | S22, S26, S36/37/39, S45 |
| BM kimlik numaraları | BM 1490 |
| HS kodu | 28416100 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | Yutulması veya solunması halinde toksiktir. Cilt ve göz tahrişine neden olabilir. |
Potasyum permanganatın sentezi için yöntemler
KMnO4 çeşitli yöntemlerle sentezlenebilir.
Bir yöntem, manganez dioksitin potasyum hidroksit ve klor veya hidrojen peroksit gibi bir oksitleyici madde ile reaksiyona sokulmasını içerir.
Başka bir yöntem, potasyum manganın klor gazı ile reaksiyona sokulmasını içerir.
Yine başka bir yöntem , potasyum hidroksitin manganez dioksit ile reaksiyona sokulmasını ve daha sonra elde edilen karışımın bir oksitleyici madde ile oksitlenmesini içerir.
Sentez işlemi genellikle reaktanların belirli bir sıcaklığa ısıtılmasını ve sıcaklığın belirli bir süre korunmasını içerir. İşlem, elde edilen karışımın filtrelenmesi ve kristalizasyon yoluyla KMnO4 elde edilmesinden oluşur.
Potasyum Permanganatın Kullanım Alanları
KMnO4, güçlü oksitleyici özelliklerinden dolayı çeşitli endüstrilerde çeşitli kullanımlara sahiptir. KMnO4’ün bazı yaygın kullanımları şunlardır:
- Su Arıtma: Kirlilikleri giderebildiği ve hoş olmayan kokuları ortadan kaldırabildiği için belediye ve endüstriyel amaçlarla suyu arıtmak için kullanılır.
- Tıbbi uygulamalar: Cilt rahatsızlıklarını (egzama, dermatit ve mantar enfeksiyonları) tedavi etmek için topikal olarak kullanılır.
- Laboratuvar kullanımı: Çeşitli laboratuvar deneylerinde oksitleyici madde olarak ve biyolojide hücre ve dokuları vurgulamak için leke olarak kullanılır.
- Tarım: Mahsulleri zararlı zararlılara ve hastalıklara karşı korumak için fungisit ve bakterisit olarak kullanılır.
- Kimya: Analitik kimyada belirli kimyasalların konsantrasyonunu belirlemek için ve organik kimyada kimyasal reaksiyonlarda reaktif olarak kullanılır.
- Yangınla Mücadele: Alev geciktirici olarak ve belirli yangın türlerini söndürmek için kullanılır.
- Endüstriyel uygulamalar: Kimyasalların, tekstillerin ve pillerin üretiminde kullanılır.
Sorular:
S: Potasyum permanganat parçalandığında hangi gaz açığa çıkar?
C: KMnO4 parçalandığında oksijen gazı (O2) açığa çıkar.
S: Potasyum permanganat nedir?
C: Potasyum permanganat, KMnO4 kimyasal formülüne sahip güçlü bir oksitleyici maddedir.
S: Potasyum permanganatın kimyasal formülü nedir?
C: Potasyum permanganatın kimyasal formülü KMnO4’tür.
S: Potasyum permanganat kristalleri nereden satın alınır?
C: KMnO4 kristalleri kimyasal tedarikçilerden, laboratuvar tedarik şirketlerinden ve çevrimiçi perakendecilerden satın alınabilir.
S: KMnO4 nedir?
C: KMnO4 potasyum permanganatın kimyasal formülüdür.
S: KMnO4’teki manganezin oksidasyon sayısı nedir?
C: KMnO4’teki manganezin oksidasyon sayısı +7’dir.
Soru: KMnO4’teki oksijenin oksidasyon sayısı nedir?
C: KMnO4’teki oksijenin oksidasyon sayısı -2’dir.
Soru: 25,0 gram KMnO4’te kaç mol vardır?
C: 25,0 gram KMnO4’teki mol sayısını hesaplamak için verilen kütleyi KMnO4’ün molar kütlesine bölmemiz gerekir. KMnO4’ün molar kütlesi 158.034 g/mol’dür. Dolayısıyla 25,0 gramda yaklaşık 0,158 mol KMnO4 bulunur.
