Potasyum nitrit (KNO2), gıda koruyucu olarak yaygın olarak kullanılan kimyasal bir bileşiktir. Bakteri üremesini engellediği, et ve diğer gıdaların bozulmasını önlediği bilinmektedir.
| IUPAC Adı | Potasyum Nitrit |
| Moleküler formül | KNO2 |
| CAS numarası | 7758-09-0 |
| Eş anlamlı | Nitröz asit, potasyum tuzu; güherçile(III); nitröz asit, bileşik. potasyum tuzu (1:1) ile; E249 |
| InChI | InChI=1S/K.NO2/c;2-1-3/q+1;-1 |
Potasyum nitritin özellikleri
Potasyum Nitrit Formülü
Potasyum nitritin kimyasal formülü KNO2’dir. Bileşiğin bileşimini, kendisini oluşturan atomlar açısından temsil eder. Potasyum nitritin formülü, molar kütlesini ve moleküler ağırlığını hesaplamak için kullanılır.
Potasyum Nitrit Molar Kütlesi
KNO2’nin molar kütlesi 85,103 g/mol’dür. Potasyum (39,10 g/mol), nitrojen (14,01 g/mol) ve iki oksijen atomunun (2 x 16,00 g/mol) atomik kütlelerinin toplamından türetilir. KNO2’nin molar kütlesi, belirli bir kütle veya hacimde maddenin ne kadarının bulunduğunu belirlemede esastır.
Potasyum nitritin kaynama noktası
KNO2’nin kaynama noktası 320°C’dir (608°F). Bu sıcaklıkta bileşik sıvı fazdan gaz fazına dönüşür. KNO2’nin kaynama noktası basınç ve saflık gibi çeşitli faktörlere bağlıdır.
Potasyum Nitrit Erime Noktası
KNO2’nin erime noktası 441°C’dir (826°F). Bu sıcaklıkta katı bileşik sıvı faza dönüşür. KNO2’nin erime noktası, gıda muhafazası ve ilaç gibi çeşitli uygulamalara uygunluğunun belirlenmesinde çok önemli bir parametredir.
Potasyum nitritin yoğunluğu g/mL
KNO2’nin yoğunluğu oda sıcaklığında 1,915 g/mL’dir. Bir maddenin yoğunluğu, maddenin birim hacim başına kütlesi olarak tanımlanır. KNO2’nin yoğunluğu, çözünürlüğü ve kimyasal reaktivitesi gibi fiziksel özelliklerinin belirlenmesinde önemli bir rol oynar.
Potasyum Nitrit Molekül Ağırlığı
KNO2’nin moleküler ağırlığı 85.103 g/mol’dür. KNO2 içeren bir reaksiyonun stokiyometrisini belirlemek için çok önemli bir parametredir. KNO2’nin moleküler ağırlığı aynı zamanda fiziksel ve kimyasal özelliklerini belirlemek için de kullanılır.
Potasyum nitritin yapısı
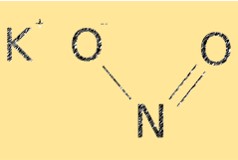
KNO2’nin moleküler formülü KNO2’dir. Potasyum katyonları (K+) ve nitrit anyonlarından (NO2-) oluşan iyonik bir yapıya sahiptir. Nitrit iyonu, yaklaşık 115°’lik bir bağ açısına sahip, kavisli bir moleküler geometriye sahiptir. KNO2’nin yapısı, çözünürlüğü ve reaktivitesi gibi kimyasal özelliklerinin belirlenmesinde esastır.
Potasyum nitritin çözünürlüğü
KNO2 suda çok çözünür ve 20°C’de yaklaşık 710 g/L’lik bir çözünürlüğe sahiptir. KNO2’nin çözünürlüğü sıcaklık, basınç ve diğer maddelerin varlığı gibi çeşitli faktörlere bağlıdır. KNO2’nin çözünürlüğü, gıda muhafazası ve ilaç gibi çeşitli uygulamalara uygunluğunun belirlenmesinde çok önemli bir parametredir.
| Dış görünüş | Beyaz ila sarımsı kristal katı |
| Spesifik yer çekimi | 1.915 |
| Renk | Renksizden beyaza |
| Koku | Kokusuz |
| Molar kütle | 85.103 gr/mol |
| Yoğunluk | 1,915 g/mL |
| Füzyon noktası | 441°C (826°F) |
| Kaynama noktası | 320°C (608°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çok çözünür (20°C’de 710 g/L) |
| çözünürlük | Etanolde çözünür, amonyakta az çözünür |
| Buhar basıncı | 25°C’de 0,0038 mmHg |
| Buhar yoğunluğu | 2,96 (hava = 1) |
| pKa | 3.35 |
| pH | 5-8 (%5 çözüm) |
Potasyum Nitrit Güvenliği ve Tehlikeleri
Yanlış kullanıldığında KNO2 tehlikeli olabilir. Yutulması veya solunması halinde zararlıdır ve gözlerde, ciltte ve solunum sisteminde tahrişe neden olabilir. KNO2’ye uzun süreli veya tekrarlı maruz kalma, kanın oksijen taşıma yeteneğini azaltan bir durum olan methemoglobinemiye neden olabilir. KNO2 aynı zamanda güçlü bir oksitleyici maddedir ve yanıcı maddelerle şiddetli reaksiyona girerek yangına veya patlamaya neden olabilir. KNO2 kullanılırken koruyucu ekipman kullanımı, yeterli havalandırma ve güvenli depolama gibi uygun güvenlik önlemlerine uyulmalıdır. Yutulması veya solunması halinde derhal tıbbi yardıma başvurun.
| Tehlike sembolleri | Xn |
| Güvenlik Açıklaması | S22, S24/25 |
| BM kimlik numaraları | BM 1488 |
| HS kodu | 2834.29.10 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | III |
| Toksisite | Yutulması veya solunması halinde zararlıdır, methemoglobinemiye neden olabilir |
Potasyum nitrit sentez yöntemleri
Potasyum hidroksit (KOH), nitröz asit (HNO2) ile reaksiyona girerek KNO2’yi sentezler. Reaksiyon yan ürünler olarak KNO2 ve su (H2O) üretir. Endüstri bu yöntemi büyük miktarlarda KNO2 üretmek için yaygın olarak kullanır.
Reaksiyon denklemi:
2 KOH + HNO2 → KNO2 + 2 H2O
KNO2’yi sentezlemenin bir başka yöntemi , potasyum karbonatın (K2CO3) nitrik oksit (NO) ile reaksiyona sokulmasıdır. Reaksiyon yan ürünler olarak KNO2, karbon dioksit (CO2) ve nitrojen (N2) üretir. Nitrik oksit elde etmek zor ve pahalı olduğundan bu yöntemin daha az kullanılmasına neden olur.
Reaksiyon denklemi:
2 K2CO3 + 2 NO → 2 KNO2 + 2 CO2 + N2
KNO2, SO2 veya FeSO4 gibi bir indirgeyici madde kullanılarak KNO3’ün oksitlenmesiyle elde edilebilir.
Reaksiyon, yan ürünler olarak KNO2, su ve indirgeyici maddenin indirgenmiş formunu üretir. Bilim insanları bu yöntemi daha az kullanıyor ve genellikle küçük ölçekli laboratuvar sentezlerine ayırıyor.
Sülfür dioksit ile reaksiyonun denklemi şöyledir:
2 KNO3 + 3 SO2 + H2O → 2 KNO2 + 3 H2SO4
Potasyum Nitritin Kullanım Alanları
KNO2 kimyasal özelliklerinden dolayı çeşitli endüstriyel ve laboratuvar uygulamalarına sahiptir. KNO2’nin yaygın kullanımlarından bazıları şunlardır:
- Gıda Muhafazası: Kürlenmiş etlerde zararlı bakterilerin üremesini önlemek ve raf ömrünü uzatmak amacıyla koruyucu olarak kullanılır.
- Kimya Endüstrisi: Nitröz asit, diazonyum bileşikleri ve organik nitritler gibi çeşitli kimyasalların üretiminde ara madde olarak kullanılır.
- Tarım: Suda çözünürlüğünün yüksek olması ve azot salma özelliğinden dolayı gübre ve toprak düzenleyici olarak kullanılır.
- Laboratuvar Reaktifi: Birincil aminlerin tespiti ve diazonyum tuzlarının hazırlanması gibi çeşitli laboratuvar uygulamalarında reaktif olarak kullanılır.
- Tıbbi kullanımı: Siyanür iyonlarıyla reaksiyona girerek toksik olmayan siyanmethemoglobin oluşturduğu için siyanür zehirlenmesinin tedavisinde kullanılır.
- Fotoğrafçılık: Geliştirilen görüntülerin kalitesini ve netliğini artırmak için fotoğraf geliştiricilerinde katkı maddesi olarak kullanılır.
- Cam Endüstrisi: Cam endüstrisinde, cam ürünlerdeki istenmeyen renklerin giderilmesinde ağartma maddesi olarak kullanılır.
Sorular:
Potasyum nitrit nedir?
C: KNO2, çeşitli endüstriyel ve laboratuvar uygulamalarında yaygın olarak kullanılan inorganik bir bileşiktir.
S: Potasyum nitritin formülü nedir?
C: Potasyum nitritin kimyasal formülü KNO2’dir.
S: NH4OH, HNO3 ile reaksiyona girdiğinde hangi tuz üretilir? KNO2, NaNO3, NH4NO3 veya NH4NO2?
C: NH4OH, HNO3 ile reaksiyona girdiğinde üretilen tuz NH4NO3’tür.
Soru: KNO2 asit mi yoksa baz mı?
C: KNO2 bazik bir bileşiktir.
Soru: Formülü KNO2 olan bileşiğin adı nedir?
C: KNO2 formülüne sahip bileşiğin adı potasyum nitrittir.
S: KNO2 zayıf bir baz mıdır?
C: KNO2 zayıf bir baz olarak kabul edilir.
S: KNO2 asidik mi yoksa bazik mi?
C: KNO2 doğası gereği baziktir ve hafif bir indirgeyici ajan olarak görev yapabilir.
