Potasyum karbonat (K2CO3), sabun, cam ve seramik üretiminde yaygın olarak kullanılan beyaz, kokusuz bir tozdur. İlaç endüstrisinde gıda katkı maddesi ve tamponlama maddesi olarak da kullanılabilir.
| IUPAC’ın adı | Potasyum karbonat |
| Moleküler formül | K2CO3 |
| CAS numarası | 584-08-7 |
| Eş anlamlı | Karbonik asit, dipotasyum tuzu; İnci külü; Potas; Tartar tuzu; Potasyum monokarbonat; Potasyum hidrojen karbonat |
| InChI | InChI=1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);/q;2*+1/p-2/fC03.2K/q-2; M |
Potasyum karbonatın özellikleri
Potasyum Karbonat Formülü
Potasyum karbonatın kimyasal formülü K2CO3’tür. Bu formül, bileşikteki her bir elementin tam atom sayısını temsil eder. Formül, bileşiğin molar kütlesini ve diğer özelliklerini hesaplamak için kullanılabilir.
Potasyum Karbonat Molar Kütlesi
K2CO3’ün molar kütlesi 138,21 g/mol’dür. Bu, bir mol K2CO3’ün 138.21 gram bileşik içerdiği anlamına gelir. Molar kütle, belirli bir reaksiyon veya deney için bir maddenin ne kadarının gerekli olduğunu belirlemede önemlidir. Kütleyi bir maddenin molüne dönüştürmek için de kullanılır.
Potasyum karbonatın kaynama noktası
K2CO3’ün 1.620 °C (2.948 °F) gibi nispeten yüksek bir kaynama noktası vardır. Bu, cam ve seramik üretimi gibi yüksek sıcaklık uygulamalarında faydalı olmasını sağlar. Kaynama noktası, bir maddenin sıvı halden gaz haline geçtiği sıcaklıktır.
Potasyum Karbonat Erime Noktası
K2CO3’ün erime noktası 891°C’dir (1,636°F). Bu nispeten yüksek erime noktası, bileşiğin iyonik yapısından kaynaklanmaktadır. Isıtıldığında maddenin erimesi için potasyum ve karbonat iyonları arasındaki iyonik bağların kırılması gerekir.
Potasyum Karbonatın Yoğunluğu g/mL
K2CO3’ün yoğunluğu oda sıcaklığında 2,43 g/mL’dir. Bu, belirli bir hacimdeki K2CO3’ün belirli bir kütleye sahip olduğu anlamına gelir. Bir maddenin yoğunluğu, maddeyi tanımlamak ve belirli bir alandaki maddenin kütlesini veya hacmini hesaplamak için kullanılabilecek önemli bir özelliktir.
Potasyum Karbonat Molekül Ağırlığı
K2CO3’ün moleküler ağırlığı 138,21 g/mol’dür. Bu, birçok kimyasal hesaplamada önemli olan bileşiğin bir molünün kütlesidir.
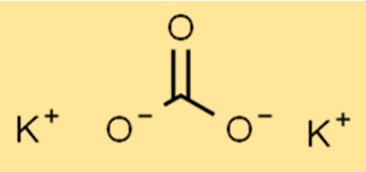
Potasyum karbonatın yapısı
K2CO3, K2CO3 formülüne sahip iyonik bir yapıya sahiptir. Potasyum iyonu (K+) ve karbonat iyonu (CO32-) iyonik bağlarla bir arada tutulur. Karbonat iyonu, bir karbon atomu ve üç oksijen atomundan oluşan çok atomlu bir iyondur.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yoğunluk | 2.43 |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 138,21 gr/mol |
| Yoğunluk | 2.43g/ml |
| Füzyon noktası | 891°C (1.636°F) |
| Kaynama noktası | 1620°C (2948°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 112 g/100 mL |
| çözünürlük | Suda, gliserolde ve alkolde çözünür |
| Buhar basıncı | Oda sıcaklığında ihmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 10:33. |
| pH | 11,5 (10 g/L’de sulu çözelti) |
Potasyum Karbonat Güvenliği ve Tehlikeleri
K2CO3’ün genellikle sanayi ve ev ürünlerinde kullanımı güvenli kabul edilir. Ancak cildi ve gözleri tahriş edebilir ve tozun solunması solunum yolu tahrişine neden olabilir. Yüksek konsantrasyonlarda K2CO3 tozuna uzun süre maruz kalmak akciğer hasarına neden olabilir. Bu bileşiği kullanırken eldiven, gözlük ve maske dahil uygun kişisel koruyucu ekipmanın kullanılması önemlidir. K2CO3 yanıcı veya patlayıcı değildir ancak asitlerle reaksiyona girerek kapalı alanlarda tehlikeli olabilecek karbondioksit üretebilir. Yutulması veya cilt veya gözlerle teması halinde derhal tıbbi yardıma başvurun.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Eldiven, gözlük ve maske takın. Cilt ve gözlerle uzun süreli temastan kaçının. Tozu solumayın. |
| BM kimlik numaraları | UN1863 |
| HS kodu | 2836.40.00 |
| Tehlike sınıfı | Tehlikeli değil |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Potasyum karbonat toksik olarak kabul edilmez ancak yüksek konsantrasyonlarda solunum ve cilt tahrişine neden olabilir. Yüksek konsantrasyondaki toza uzun süre maruz kalmak akciğer hasarına neden olabilir. |
Potasyum karbonat sentez yöntemleri
K2CO3’ü çeşitli yöntemler sentezleyebilir
Yaygın bir yöntem, potasyum hidroksitin karbon dioksitle reaksiyona sokulmasıdır.
Karbondioksitin kaçmasını önlemek için bu reaksiyon kapalı bir kapta gerçekleştirilebilir.
Başka bir yöntem , potasyum klorürün sulu bir çözelti içinde sodyum karbonatla reaksiyona sokulmasını içerir. Ortaya çıkan K2CO3 çözeltiden çöker ve filtrasyon yoluyla toplanabilir.
K2CO3’ü sentezlemenin bir başka yolu, potasyum sülfatın kömür varlığında karbonla reaksiyona sokulmasıdır. Tarihsel olarak kimyagerler, endüstriyel ölçekte K2CO3 üretmek için Leblanc sürecini kullandılar. Ancak çevresel kaygılar, kükürt dioksit açığa çıkardığı için bu işlemi günümüzde nadir hale getirmiştir.
K2CO3, potasyum bikarbonatın yüksek sıcaklıklara ısıtılması ve K2CO3 ve karbondioksite ayrışmasının sağlanmasıyla sentezlenebilir. Bu reaksiyonu bir fırın veya fırın gerçekleştirebilir.
Potasyum Karbonatın Kullanım Alanları
K2CO3 benzersiz özellikleri nedeniyle çeşitli endüstrilerde geniş bir uygulama alanına sahiptir. Yaygın kullanımlarından bazıları şunlardır:
- Cam üretimi: Silika ve diğer bileşenlerin erime noktasını düşürmek için eritken olarak kullanılır.
- Gıda endüstrisi: Asitliği düzenlemek için gıda katkı maddesi olarak ve fırınlamada ayırıcı madde olarak kullanılır.
- Sabun ve Deterjanlar: Ayrıca sabun ve deterjan yapımında su yumuşatıcı olarak kullanılır.
- İlaç Endüstrisi: İlaç formülasyonlarında tamponlayıcı madde olarak kullanılır.
- Gübre: Tarımda bitkilere potasyum sağlamak amacıyla gübre olarak da kullanılır.
- Seramik üretimi: Pişirme sıcaklığını düşürmek ve bitmiş ürünün kalitesini artırmak için eritken olarak kullanılır.
- Havai Fişek: Havai fişek üretiminde mor bir alev üretmek için kullanılır.
- Piller: Pil üretiminde elektrolit olarak kullanılır.
- Tekstil endüstrisi: Boya maddesi olarak kullanılır.
Sorular:
S: Potasyum karbonat çözünür mü?
C: Evet, potasyum karbonat suda çözünür.
Soru: K2CO3 suda çözünür mü?
C: Evet, K2CO3 suda çözünür. Aslında çok çözünür ve suda çözünerek berrak, renksiz bir çözelti oluşturabilir.
Soru: 200 ml 2,5 M çözelti hazırlamak için kaç gram potasyum karbonata ihtiyaç vardır?
C: 200 ml suda 2,5 M K2CO3 çözeltisi hazırlamak için 33,25 gram K2CO3’ü suda çözmeniz gerekir.
Hesaplama: Molarite = mol / hacim (litre cinsinden) 2,5 M = mol / 0,2 L mol = 0,5 mol kütle = mol x molar kütle kütle = 0,5 mol x 138,21 g/mol kütle = 33,25g
S: Tam ayrışma varsayıldığında 0,045 M K2CO3 çözeltisindeki K iyonlarının konsantrasyonu nedir?
C: K2CO3 suda tamamen ayrıştığında iki K+ iyonu ve bir CO3 2- iyonu oluşturur. Bu nedenle, 0,045 M K2CO3 çözeltisindeki K+ iyonlarının konsantrasyonu, 0,090 M olan K2CO3 çözeltisinin molaritesinin iki katı olacaktır.
