Potasyum fosfat (K3PO4), potasyum ve fosfor elementlerini içeren bir bileşiktir. Yüksek çözünürlüğü ve bitki büyümesi için gerekli besinleri sağlama yeteneği nedeniyle yaygın olarak gıda katkı maddesi ve gübre olarak kullanılır.
| IUPAC’ın adı | Potasyum fosfat |
| Moleküler formül | K3PO4 |
| CAS numarası | 7778-53-2 |
| Eş anlamlı | Tripotasyum fosfat, potasyum ortofosfat, tersiyer potasyum fosfat, tripotasyum monofosfat, tribazik potasyum fosfat |
| InChI | InChI=1S/3K.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Potasyum fosfatın özellikleri
Potasyum Fosfat Formülü
Potasyum fosfatın kimyasal formülü K3PO4’tür. Bu, bileşiğin her formül biriminde üç K+ iyonu ve bir PO43- iyonu içerdiğini gösterir. Potasyum fosfat formülü, bileşiği içeren reaksiyonların stokiyometrisinin belirlenmesinde ve ayrıca bileşiğin belirli bir kütlesinde mevcut olan her bir elementin miktarının belirlenmesinde faydalıdır.
Potasyum Fosfat Molar Kütlesi
K3PO4’ün molar kütlesi 212,27 g/mol’dür. Bileşiğe potasyum, fosfor ve oksijenin atomik kütleleri eklenerek hesaplanır. Molar kütle, bileşiğin belirli bir kütlesinde mevcut olan madde miktarını belirlemek için önemli bir parametredir. Ayrıca K3PO4 içeren reaksiyonların stokiyometrisinin hesaplanmasında da faydalıdır.
Potasyum fosfatın kaynama noktası
K3PO4’ün kaynama noktası 1660°C’dir. Bu yüksek kaynama noktası, bileşikteki K+ iyonları ile PO43- iyonları arasındaki güçlü iyonik bağlardan kaynaklanmaktadır. Bu aynı zamanda bileşiğin yüksek sıcaklıklardaki stabilitesinin de bir göstergesidir. K3PO4’ün kaynama noktası seramik ve cam üretimi gibi çeşitli endüstriyel uygulamalarda faydalıdır.
Potasyum Fosfatın Erime Noktası
K3PO4’ün erime noktası 1340°C’dir. Bu, katı bileşiğin sıvı duruma geçtiği sıcaklıktır. K3PO4’ün yüksek erime noktası, bileşiğin iyonik doğasından kaynaklanmaktadır; bu, iyonlar arasındaki çekim kuvvetlerinin üstesinden gelmek için büyük miktarda enerji gerektirir. K3PO4’ün erime noktası, gübre ve gıda katkı maddeleri üretimi gibi çeşitli uygulamalara uygunluğunun belirlenmesinde faydalıdır.
Potasyum fosfatın yoğunluğu g/mL
K3PO4’ün yoğunluğu oda sıcaklığında 2,564 g/mL’dir. Bileşiğin yüksek yoğunluğu, her formül biriminde üç K+ iyonunun ve bir PO43- iyonunun varlığından kaynaklanmaktadır. K3PO4’ün yoğunluğu, gübre ve gıda katkı maddeleri üretimi gibi çeşitli endüstriyel işlemlerdeki çözünürlüğünün ve davranışının belirlenmesinde faydalıdır.
Potasyum Fosfat Molekül Ağırlığı
K3PO4’ün moleküler ağırlığı 212,27 g/mol’dür. Bileşikteki tüm atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı, bileşiğin belirli bir kütlesinde bulunan madde miktarının hesaplanmasında ve aynı zamanda K3PO4 içeren reaksiyonların stokiyometrisinin belirlenmesinde faydalıdır.
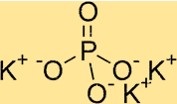
Potasyum fosfatın yapısı
K3PO4 ortorombik bir kristal yapıya sahiptir. Her fosfat iyonunun komşu fosfat iyonlarıyla iki oksijen atomunu paylaştığı bir dizi PO4 tetrahedradan oluşur. Potasyum iyonları, oksijen atomlarıyla çevrili fosfat tetrahedra arasında bulunur. K3PO4’ün yapısı, çözünürlüğü ve termal kararlılığı gibi özelliklerini anlamak için faydalıdır.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yoğunluk | 2.564 g/mL |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 212,27 gr/mol |
| Yoğunluk | 2.564 g/mL |
| Füzyon noktası | 1340°C |
| Kaynama noktası | 1660°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 100 g/L (20°C) |
| çözünürlük | Etanol ve asetonda çözünür, eterde çözünmez |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | pKa1 = 2,16, pKa2 = 7,21, pKa3 = 12,32 |
| pH | %1’lik bir çözeltinin pH’ı 11,5’tir |
Potasyum Fosfat Güvenliği ve Tehlikeleri
K3PO4’ün doğru şekilde kullanıldığında genellikle güvenli olduğu kabul edilir. Ancak diğer kimyasallar gibi yanlış kullanıldığında veya büyük miktarlarda yutulduğunda tehlike oluşturabilir. Bileşik cilt, göz ve solunum yolu tahriş edici olarak sınıflandırılmıştır ve yüksek konsantrasyonlarda solunması veya yutulması halinde ciddi yanıklara veya solunum sıkıntısına neden olabilir. Ayrıca asitler ve oksitleyici maddelerle de uyumlu değildir ve bu maddelere maruz kalması halinde yangına veya patlamaya neden olabilir. Bu nedenle K3PO4’ü dikkatli bir şekilde kullanmak, uygun koruyucu ekipman giymek ve serin, kuru, iyi havalandırılmış, uyumsuz maddelerden uzak bir alanda saklamak önemlidir.
| Tehlike sembolleri | Xi (Rahatsız edici) |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının. |
| BM kimlik numaraları | UN 2833 (susuz için), UN 2423 (trihidrat için) |
| HS kodu | 28352400 |
| Tehlike sınıfı | 6.1 (zehirli) |
| Paketleme grubu | III |
| Toksisite | LD50 (oral, sıçan): 2.340 mg/kg; LC50 (soluma, sıçan): 50 mg/L |
Potasyum fosfatın (K3PO4) sentezi için yöntemler
K3PO4’ü sentezlemek için, fosforik asidin (H3PO4) potasyum hidroksit (KOH) ile reaksiyonu veya KH2PO4’ün termal ayrışması dahil olmak üzere çeşitli yöntemler mevcuttur.
Bir yöntem, eş molar miktarlarda KOH ve H3PO4’ün yaklaşık 60 ila 80°C sıcaklıkta su içinde reaksiyona sokulmasını içerir. Prosedür, elde edilen karışımın buharlaştırılmasını ve katı kalıntının yaklaşık 300°C’ye ısıtılarak K3PO4 üretilmesini içerir.
Diğer bir yöntem ise K3PO4 ve su üretmek için KH2PO4’ün KOH ile yüksek sıcaklıkta (400°C’nin üzerinde) reaksiyona sokulmasıdır. Özel bir fırın, termal ayrışma adı verilen bu işlemi gerçekleştirebilir.
Fosforik asidin potasyum karbonat (K2CO3) ile reaksiyonu ve potasyum oksidin (K2O) fosfor pentoksit (P2O5) ile reaksiyonu, K3PO4 üretimine yönelik ilave yöntemlerdir.
Potasyum Fosfatın Kullanım Alanları
K3PO4’ün aşağıdakiler de dahil olmak üzere çeşitli endüstrilerde çeşitli pratik kullanımları vardır:
- Gübre: Yüksek fosfor içeriği nedeniyle yaygın olarak gübre olarak kullanılır. Çiftçiler genellikle bitkilere gerekli besinleri sağlamak için onu toprağa eklerler.
- Gıda Endüstrisi: Asitlik seviyelerini düzenlemek, renk bozulmalarını önlemek ve dokuyu iyileştirmek amacıyla gıda katkı maddesi olarak kullanılır.
- Tamponlama maddesi: Çeşitli laboratuvar uygulamaları, pH kalibrasyon tampon çözeltileri ve biyolojik araştırmalar da dahil olmak üzere onu etkili bir tamponlama maddesi olarak kullanır.
- Deterjanlar: Suyu yumuşatma ve mineral birikintilerinin oluşumunu önleme özelliğinden dolayı deterjan ve temizlik ürünlerinin üretiminde kullanılır.
- Tıp: Düşük kan fosfat seviyeleri gibi belirli tıbbi durumların tedavisinde besin takviyesi olarak kullanılır.
- Su Arıtma: Su arıtımında boru ve ekipmanlarda kireç oluşumunu ve korozyonu önlemek amacıyla kullanılır.
- Alev Geciktirici: Su buharını serbest bırakma ve alevlerin yayılmasını önleme özelliği nedeniyle tekstil ve plastik dahil çeşitli malzemelerde alev geciktirici olarak kullanılır.
Sorular:
Soru: Potasyum fosfat suda çözünür mü?
C: Evet, K3PO4 suda çözünür.
S: Bir fosfat iyonuna bağlanmak için kaç tane potasyum iyonuna ihtiyaç vardır?
C: Bir fosfat iyonuna bağlanarak K3PO4’ü oluşturmak için üç potasyum iyonu gerekir.
S: Kalsiyum bromür ve potasyum fosfatın sulu çözeltileri karıştırıldığında hangi çökelti oluşur?
C: Kalsiyum bromür ve K3PO4’ün sulu çözeltileri karıştırıldığında, bir kalsiyum fosfat (Ca3(PO4)2) çökeltisi oluşur.
S: k3po4 suda çözünür mü?
C: Evet, K3PO4 suda çözünür.
S: k3po4 çözünür mü?
C: Evet, K3PO4 suda çözünür.
S: Ni(C2H3O2)2 (sulu) ve K3PO4 (sulu) sulu çözeltilerinin karıştırılmasından hangi ürünler ortaya çıkar?
C: Ni(C2H3O2)2 ve K3PO4’ün sulu çözeltileri karıştırıldığında, potasyum asetat (KCH3COO) ve asetik asitin (CH3COOH) sulu çözeltileri gibi, bir nikel(II) fosfat (Ni3(PO4)2) çökeltisi oluşur.
Soru: Bu reaksiyonda hangi element oksidasyon sayısını artırır? 3KOH + H3PO4 → K3PO4 + 3H2O
C: Fosfor elementi oksidasyon sayısını H3PO4’te +5’ten K3PO4’te +5’e yükseltir.
S: K3PO4 nedir?
C: K3PO4, gübreler, gıda katkı maddeleri ve temizlik ürünleri gibi çeşitli uygulamalarda kullanılan bir bileşik olan potasyum fosfatın kimyasal formülüdür.
