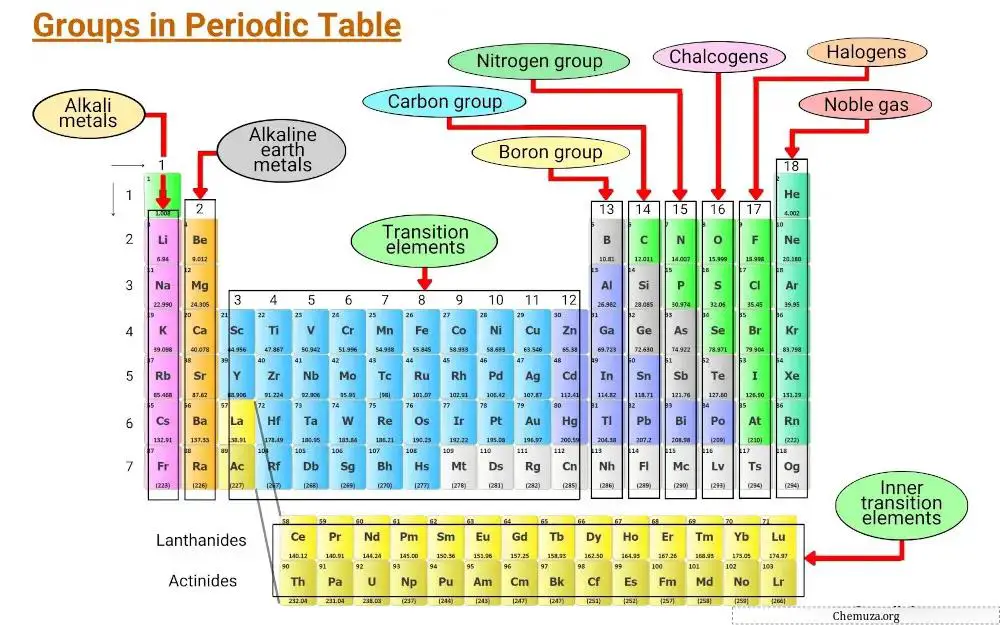
Elementler, elektronik konfigürasyonlar ve değerlik elektronlarının davranışları dahil olmak üzere ortak özelliklere göre gruplandırılır.
Periyodik tablonun dikey sütunlarına gruplar denir ve periyodik tabloda her biri bir elementin diğer elementlerle nasıl etkileşime gireceğini ve bileşikler oluşturacağını belirleyen kendi özelliklerine sahip 18 grup vardır.
Bu yazıda periyodik tablodaki farklı grupları inceleyeceğiz.
Hemen konuya geçelim!
Grup 1: Alkali metaller
Periyodik tablonun 1. Grubuna alkali metaller denir.
Bu grup lityum, sodyum, potasyum, rubidyum, sezyum ve francium içerir.
Alkali metaller yumuşaklıkları, düşük erime noktaları ve su ve hava ile yüksek reaktiviteleri ile bilinir.
Alkali metaller çok reaktiftir çünkü en dış kabuklarında kolayca pozitif iyonlar oluşturmak üzere vazgeçebilecekleri tek bir elektron vardır. [1]
Bu onları mükemmel elektrik iletkenleri haline getirir ve piller ve endüstriyel işlemler de dahil olmak üzere birçok uygulamada kullanışlıdır.
Ancak yüksek reaktiviteleri nedeniyle alkali metallerin dikkatle kullanılması gerekir. Havada kendiliğinden tutuşabilir ve suyla patlayıcı bir şekilde reaksiyona girerek hidrojen gazı açığa çıkarabilirler. [2]
Grup 2: Alkali toprak metaller
Periyodik tablonun 2. Grubu ” toprak alkali metaller ” olarak bilinir. Bu grup altı element içerir: berilyum, magnezyum, kalsiyum, stronsiyum, baryum ve radyum.
Bu metallere “alkali” adı verilir çünkü suyla reaksiyona girerek alkali (bazik) çözeltiler oluştururlar.
Alkali toprak metaller, yüksek erime ve kaynama noktaları, düşük yoğunluklar ve kolayca +2 yüklü iyonlar oluşturabilme gibi benzer özelliklere sahiptir.
Ayrıca özellikle su ve oksijene karşı çok reaktiftirler. Ancak Grup 1 alkali metallerden farklı olarak daha az reaktiftirler ve daha yüksek bir erime noktasına sahiptirler.
Bu elementler kemikler (kalsiyum), havai fişekler (stronsiyum) ve uçak parçaları (magnezyum) dahil olmak üzere birçok günlük nesnede bulunur.
Alkali toprak metaller aynı zamanda alüminyum ve çelik üretimi gibi endüstriyel işlemlerde de kullanılır.
Grup 3 – 11: Geçiş metalleri
Periyodik tablonun 3’ten 11’e kadar olan grupları geçiş metali grubu olarak bilinir. Bu metaller, onları masadaki diğer eşyalardan ayıran benzersiz özelliklere sahiptir.
Geçiş metallerinin belirleyici özelliklerinden biri renkli bileşikler oluşturma yetenekleridir.
Bunun nedeni, ışığın belirli dalga boylarını absorbe etmelerine ve yansıtmalarına olanak tanıyan benzersiz elektronik konfigürasyonlarıdır. [3]
Geçiş metalleri aynı zamanda yüksek erime ve kaynama noktalarının yanı sıra mukavemet ve dayanıklılıklarıyla da bilinir.
Genellikle inşaat malzemeleri, elektrik kabloları ve hatta mücevherlerde kullanılırlar.
Grup 13: bor grubu
Periyodik tablonun 13. grubu bor grubu olarak bilinir ve bor (B), alüminyum (Al), galyum (Ga), indiyum (In), talyum (Tl) ve nihonyum (Nh) elementlerini içerir.
Bu elementler, onları kimyasal olarak benzer kılan bazı ortak özelliklere sahiptir.
Bor bu gruptaki tek metaloiddir , yani hem metal hem de ametal özelliklere sahiptir.
Grup 14: Karbon grubu
Periyodik tablonun 14. grubu Karbon grubu olarak bilinir ve Karbon (C), Silikon (Si), Germanyum (Ge), Kalay (Sn), Kurşun (Pb) ve Flerovyum (Fl) içerir.
Bu elementlerin benzer özellikleri vardır çünkü hepsinde dört değerlik elektronu vardır.
Karbon çok önemli bir elementtir çünkü proteinler ve DNA gibi yaşamın yapı taşları da dahil olmak üzere tüm organik moleküllerin temelini oluşturur. [4]
Grup 15: Piktojenler
Periyodik tablonun 15. grubu aynı zamanda nitrojen grubu (veya piktojenler) olarak da bilinir.
Bu grup 6 element içerir: azot (N), fosfor (P), arsenik (As), antimon (Sb), bizmut (Bi) ve moskoviyum (Mc).
Grup 15 elemanlarının en dış elektron kabuğunda beş değerlik elektronu vardır; bu, oktetlerini tamamlamak için üç kovalent bağ oluşturma eğiliminde oldukları anlamına gelir.
Ayrıca anyon oluşturmak için üç elektron kazanma eğilimindedirler. Grupta elementler daha az metalik olmayan ve daha fazla metalik hale gelir.
Grup 16: Kalkojenler
Periyodik tablonun 16. grubu oksijen grubu olarak bilinir. Oksijen (O), kükürt (S), selenyum (Se), tellür (Te), polonyum (Po) ve hepatik (Lv) elementlerini içerir.
Bu elementler, en dış enerji seviyelerinde altı değerlik elektronuna sahip olmak da dahil olmak üzere belirli özellikleri paylaşırlar.
Oksijen bu grubun en bol bulunan elementidir ve suyun ve birçok organik molekülün temel bileşeni olduğundan yaşam için gereklidir.
Oksijen grubundaki elementler, metaller ve ametaller de dahil olmak üzere diğer birçok elementle bileşikler oluşturabilir.
Grup 17: Halojenler
Periyodik tablonun 17. grubu halojen grubu olarak da bilinir. Altı elementten oluşur: flor, klor, brom, iyot, astatin ve tennessin.
Tüm halojenlerin değerlik kabuğu olarak da bilinen en dış kabuklarında yedi elektron bulunur. Bu onları çok reaktif hale getiriyor çünkü dış kabuklarını tamamlamak ve kararlı hale gelmek için yalnızca bir ekstra elektrona ihtiyaç duyuyorlar.
Halojenlerin bir diğer önemli özelliği de hepsinin metal olmamasıdır, yani elektriği iletmezler ve metaller gibi dövülebilir veya sünek değildirler.
Ayrıca oda sıcaklığında maddenin üç halinde de bulunurlar; flor ve klor gazdır, brom sıvıdır ve iyot ve astatin katıdır.
Grup 18: Nadir gazlar
Periyodik tablonun 18. grubu aynı zamanda soy gazlar olarak da bilinir.
Soy gazlar arasında helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) bulunur.
Bu gazlara soy gazlar denir çünkü çok kararlıdırlar ve diğer elementlerle kolayca reaksiyona girmezler.
Soygazlar periyodik tablonun en sağ sütununda yer alır ve hepsinin dış elektron kabukları doludur, bu da onları çok tepkisiz hale getirir.
Ayrıca kokusuz, renksiz ve düşük kaynama ve erime noktalarına sahiptirler.
