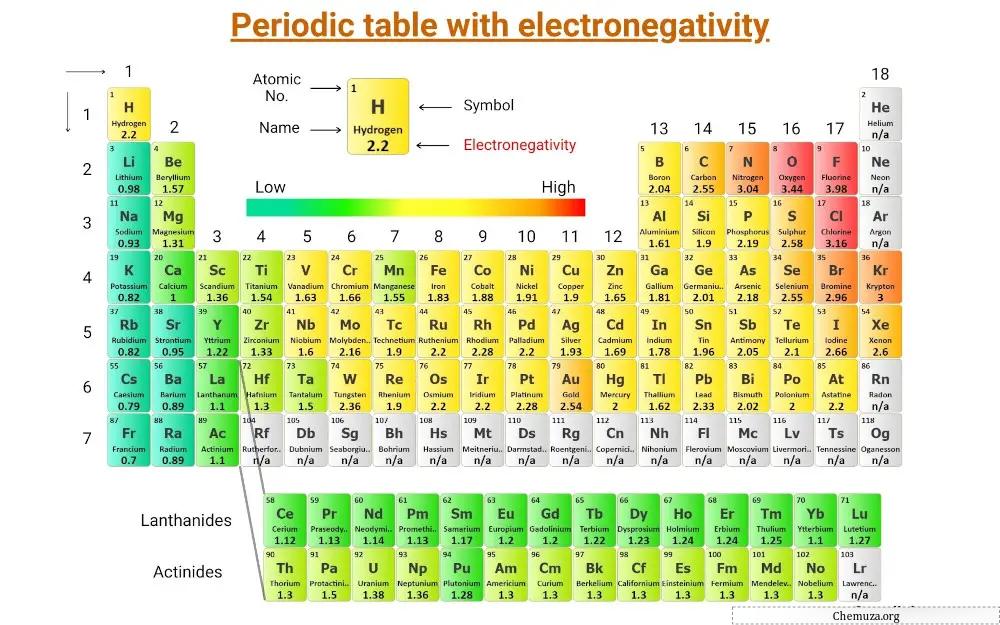
Bu, elementlerin elektronegatifliğinin kaydedildiği periyodik bir tablodur .
(Not: Elektronegatifliğin birimi yoktur. Linus Pauling, elementleri birbirine göre sıralayan bir elektronegatiflik ölçeği tasarlayan bir bilim adamıydı. Ve bu ölçek, elektronegatiflik ölçeği Pauling’in elektronegatifliği olarak bilinir.) [1]
Elektronegatifliğin ne olduğunu bilmiyorsanız, işte bununla ilgili kısa bir açıklama.
Elektronegatiflik nedir?
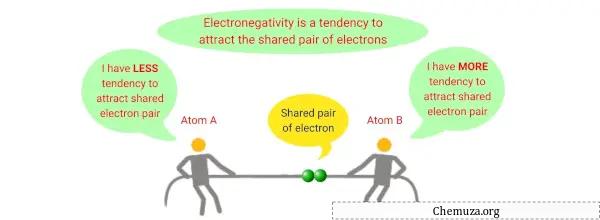
Elektronegatiflik, bir atomun , bir bileşiğin veya molekülün parçası olduğunda elektronları kendine doğru çekme yeteneğini tanımlayan kimyasal bir özelliktir.
Bir atomun kovalent bir bağda paylaşılan elektronlara uyguladığı göreceli çekimin bir ölçüsüdür.
Elektronegatiflik neden önemlidir?
Elektronegatiflik, moleküllerin kimyasal bağlarının, reaktivitesinin ve fiziksel özelliklerinin doğasını tahmin etmede çok önemli bir rol oynar.
Bu, belirli elementlerin neden kovalent veya iyonik bağlar gibi belirli türde bağlar oluşturma eğiliminde olduğunu ve bu bağların ortaya çıkan bileşiğin davranışını nasıl etkilediğini açıklamaya yardımcı olur.
Elektronegatiflik ayrıca bir molekülün polaritesini ve diğer moleküllerle olan etkileşimlerini tahmin etmeye de yardımcı olur; bu kimya, biyoloji ve malzeme bilimi dahil birçok alanda önemlidir.
Daha yüksek elektronegatiflik ne anlama geliyor?
Bir atomun elektronegatifliği daha yüksek olduğunda, bu, kimyasal bir bileşiğin veya molekülün parçası olduğunda elektronları kendine çekme yeteneğinin daha yüksek olduğu anlamına gelir.
Bu, elektronların atomlar arasında eşit olarak paylaşılmadığı polar kovalent bağların oluşumuna yol açar.
Elektronegatifliği yüksek olan atom, kendisine yakın olan elektronları çekerek kısmi negatif yüke neden olurken, bağdaki diğer atom kısmi pozitif yüke sahip olur.
Bu polarite, bileşiğin kaynama ve erime noktaları, çözünürlüğü ve reaktivitesi gibi fiziksel ve kimyasal özelliklerini etkiler.
Elektronegatifliği yüksek elementlerin örnekleri arasında flor, oksijen ve nitrojen bulunur.
