Azot triflorür veya NF3, elektronik endüstrisinde plazma aşındırma ve temizleme için kullanılan güçlü bir sera gazıdır. Uzun bir atmosferik ömrü vardır ve iklim değişikliğine katkıda bulunur.
| IUPAC Adı | Azot triflorür |
| Moleküler formül | NF3 |
| CAS numarası | 7783-54-2 |
| Eş anlamlı | Trifloramin, nitrojen florür (NF3), nitrojen florür (1:3), nitrojen florür (NF3), nitrojen (III) florür, nitrojen florür, tablet, UN 2451 |
| InChI | InChI=1S/F3N/c1-4(2)3 |
Azot Triflorür Molar Kütlesi
NF3’ün molar kütlesi 71,0 g/mol’dür. Bu, bir mol NF3’ün 6.022 x 10^23 molekül içerdiği anlamına gelir.
Azot triflorürün kaynama noktası
NF3’ün kaynama noktası -129,04°C veya -200,27°F’dir. Bu, diğer gazlarla karşılaştırıldığında nispeten düşüktür ve endüstriyel uygulamalarda işlenmesini kolaylaştırır.
Azot triflorür Erime noktası
Azot triflorürün erime noktası -206,73°C veya -340,11°F’dir. Bu, oda sıcaklığında NF3’ün gaz halinde olduğu anlamına gelir.
NF3 Yoğunluğu g/mL
NF3’ün yoğunluğu standart sıcaklık ve basınçta 1,88 g/mL’dir. Bu, nitrojen triflorürün havadan daha yoğun olduğu ve atmosfere salınması halinde yere çökeceği anlamına gelir.
Azot Triflorür Molekül Ağırlığı
NF3’ün moleküler ağırlığı 71,0 g/mol’dür. Bileşikteki nitrojen ve florin atom ağırlıklarının toplamıdır.
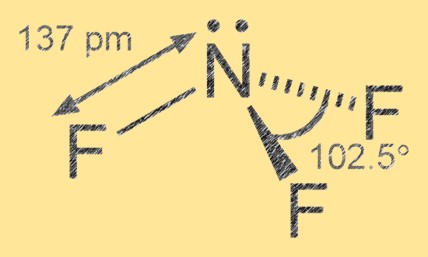
Azot triflorürün yapısı
Azot triflorür, merkezi atom olarak nitrojen ve onu çevreleyen üç flor atomu ile trigonal piramidal moleküler geometriye sahiptir. Nitrojen-flor bağı polar kovalenttir; flor atomları nitrojenden daha elektronegatiftir, bu da flor atomlarında kısmi negatif yüke ve nitrojen atomunda kısmi pozitif yüke yol açar.
Azot Triflorür Formülü
Nitrojen triflorürün kimyasal formülü NF3’tür; bu, bir NF3 molekülünün bir nitrojen atomu ve üç flor atomu içerdiğini gösterir.
| Dış görünüş | Renksiz gaz |
| Spesifik yer çekimi | 2.62 |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 71,0 g/mol |
| Yoğunluk | STP’de 1,88 g/mL |
| Füzyon noktası | -206,73°C veya -340,11°F |
| Kaynama noktası | -129,04°C veya -200,27°F |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 25°C’de 0,41 g/100 mL |
| çözünürlük | Organik çözücülerde çözünür |
| Buhar basıncı | 20°C’de 315 kPa |
| Buhar yoğunluğu | 2,01 (hava = 1) |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Azot triflorürün güvenliği ve tehlikeleri
Nitrojen triflorür (NF3) doğru şekilde kullanıldığında genellikle güvenli kabul edilir, ancak yanlış kullanıldığında çeşitli tehlikelere yol açabilir. Ciltte ve gözlerde tahrişe neden olabilir ve yüksek konsantrasyonların solunması solunum sıkıntısına neden olabilir. NF3 gazı, yetersiz havalandırılan alanlarda oksijenin yerini alarak boğulmaya neden olabilir. Aynı zamanda iklim değişikliğine katkıda bulunan güçlü bir sera gazıdır. Yangın durumunda NF3 zehirli hidrojen florür gazı açığa çıkarabilir. Bu tehlikelerden kaçınmak için NF3’ü kullanırken yeterli havalandırma ve koruyucu ekipman kullanımı da dahil olmak üzere uygun güvenlik protokollerinin takip edilmesi önemlidir.
| Tehlike sembolleri | T, C |
| Güvenlik Açıklaması | Teneffüs etmekten ve cilt ve gözlerle temasından kaçının. Yalnızca iyi havalandırılmış alanlarda kullanın. |
| BM kimlik numaraları | UN2451 |
| HS kodu | 28129090 |
| Tehlike sınıfı | 2.3 |
| Paketleme grubu | II |
| Toksisite | Çok zehirli |
Azot triflorürün sentezi için yöntemler
Nitrojen triflorürü (NF3) sentezlemek için çeşitli yöntemler mevcuttur:
Yaygın bir yöntem, demir, nikel veya platin gibi bir katalizör varlığında susuz amonyağın (NH3) flor gazı (F2) ile reaksiyonunu içerir. Reaksiyon NF3 ve hidrojen florür (HF) üretir. Endüstriler bu yöntemi NF3 üretimi için yaygın olarak kullanır.
Başka bir yöntem, amonyum florürün (NH4F) yüksek sıcaklıklarda termal bozunmasını içerir. Reaksiyon NF3 ve amonyak gazı (NH3) üretir. NH3’ün F2 ile reaksiyonu bu yönteme göre daha verimli olduğundan daha az kullanılır.
Başka bir yöntem, nitrik oksidin (NO) bir katalizör varlığında flor gazı ile reaksiyonunu içerir. Reaksiyon NF3 gazlarını ve nitrojen dioksiti (NO2) üretir.
NF3 ayrıca N2 ve F2 gazlarının bir karışımından bir elektrik deşarjının geçirilmesiyle elektrokimyasal olarak da sentezlenebilir. Ortaya çıkan plazma, NF3 ve diğer nitrojen-flor bileşiklerini oluşturur.
Kullanılan yöntem ne olursa olsun, yüksek derecede reaktif ve potansiyel olarak tehlikeli reaktiflerin uygun güvenlik önlemleriyle işlenmesi çok önemlidir. Ancak araştırmacıların, nihai ürünün yüksek verimini ve saflığını sağlamak için sentez sürecini dikkatli bir şekilde kontrol etmesi gerekiyor.
Azot triflorürün kullanımları
Azot triflorür (NF3), benzersiz özellikleri nedeniyle çeşitli endüstriyel uygulamalara sahiptir.
- Yarı iletken endüstrisi, silikon plakalar için bir temizleme maddesi olarak NF3’ü kullanır. NF3 ayrıca düz panel ekranların, güneş pillerinin ve mikroelektromekanik sistemlerin (MEMS) üretiminde de kullanılır.
- Elektronik bileşen imalatında plazma aşındırma gazı olarak NF3 kullanılır. Yüksek reaktivite sergiler ve bazı malzemeleri seçici olarak uzaklaştırırken diğerlerini sağlam bırakır.
- Soğutma sistemleri aynı zamanda diğer soğutucu akışkanlara göre daha düşük küresel ısınma potansiyeli nedeniyle soğutucu akışkan olarak NF3’ü kullanır ve bu da onu daha çevre dostu bir seçenek haline getirir.
- Havacılık endüstrisi, uzay aracının verimli bir şekilde itilmesini sağlayan yüksek özgül itkisi nedeniyle NF3’ü itici yakıt olarak kullanıyor.
Pek çok kullanımına rağmen NF3’ün çevresel etkisi konusunda endişeler var. Atmosferde uzun ömürlü, güçlü bir sera gazıdır. NF3’ün üretimi ve kullanımı, uygun önlemler alınmazsa iklim değişikliğine katkıda bulunabilir. Bu nedenle kullanımını azaltmak ve daha sürdürülebilir alternatifler geliştirmek için çaba sarf ediliyor.
Sorular:
S: Nitrojen triflorür (NF3) polar mıdır?
C: Evet, NF3 kutupsaldır. Merkezde nitrojen atomu ve çevresinde düzenlenmiş üç flor atomu ile üçgen piramit şeklinde bir moleküler geometriye sahiptir. Molekülün asimetrik şekli, elektron yoğunluğunun eşit olmayan bir dağılımına neden olur ve bu da polar bir moleküle neden olur.
S: Nitrojen triflorürün formülü nedir?
C: Nitrojen triflorürün formülü NF3’tür; bu, molekülün bir nitrojen atomu ve üç flor atomundan oluştuğunu gösterir.
S: Nitrojen triflorür nereden geliyor?
C: NF3, susuz amonyağın flor gazı ile reaksiyonu, amonyum florürün termal ayrışması ve elektrokimyasal sentez dahil olmak üzere çeşitli yöntemlerle üretilebilir. Yarı iletken endüstrisinde temizlik maddesi olarak ve elektronik bileşenlerin ve havacılık iticilerinin imalatında yaygın olarak kullanılır.
S: Nitrojen triflorürün Lewis yapısı?
C: NF3’ün Lewis yapısı, tek kovalent bağlarla üç flor atomuna bağlanan bir nitrojen atomundan oluşur. Azot atomunda ayrıca moleküle üçgen piramit şekli veren bir çift bağlanmayan elektron vardır.
S: Nitrojen triflorürün moleküller arası kuvvetleri?
C: NF3’ün moleküller arası kuvvetleri, molekülün polar doğasından kaynaklanan dipol-dipol etkileşimlerini içerir. Moleküler ayrıca elektron yoğunluğundaki geçici dalgalanmalardan kaynaklanan zayıf moleküller arası kuvvetler olan Londra dağılım kuvvetlerini de deneyiyor.
S: NF3 polar mı yoksa polar değil mi?
C: NF3, asimetrik şekli ve eşit olmayan elektron yoğunluğu dağılımı nedeniyle kutupsaldır. Molekülün bir pozitif ve negatif ucu olduğunu gösteren bir dipol momenti vardır, bu da onu polar bir molekül yapar.
