Nitrik asit (HNO3) güçlü ve oldukça reaktif bir inorganik asittir. Gübrelerde, patlayıcılarda ve tekstil boyama ve baskı endüstrisinde kullanılır. Aynı zamanda biyolojik süreçlerde ve yanma reaksiyonlarında önemli rol oynayan nitratları da oluşturur.
| IUPAC Adı | Nitrik asit |
| Moleküler formül | HNO3 |
| CAS numarası | 7697-37-2 |
| Eş anlamlı | Aqua fortis, Nitre ruhu, Nitröz asit |
| InChI | InChI=1S/HNO3/c2-1(3)4 |
Nitrik asidin özellikleri
Nitrik Asit Molar Kütlesi
Nitrik asidin molar kütlesi 63.01 g/mol’dür. 12 gram saf karbon-12 ile aynı sayıda varlık (atom, molekül veya iyon gibi) içeren madde miktarıdır.
Nitrik Asit Formülü
Nitrik asidin kimyasal formülü HNO<sub>3</sub>’dür. Moleküldeki atomların sayısını ve türünü temsil eder. Formül, kaynama noktası, erime noktası ve yoğunluk gibi fiziksel ve kimyasal özelliklerini tahmin etmek için kullanılabilir.
Nitrik asidin kaynama noktası
Nitrik asidin kaynama noktası 83,0°C’dir (181,4°F). Belirli bir basınçta bir maddenin sıvı halden gaz haline geçtiği sıcaklıktır. Nitrik asit oldukça reaktif ve uçucu bir maddedir ve kaynama noktası, hangi koşullar altında kullanılması ve saklanması gerektiğini belirlemeye yardımcı olur.
Nitrik asidin erime noktası
Nitrik asidin erime noktası -41,5°C’dir (-42,7°F). Katı bir maddenin hal değiştirerek sıvı hale geçtiği sıcaklıktır. Nitrik asidin düşük erime noktası, sıvı formda işlenmesini kolaylaştırır.
Nitrik asit yoğunluğu g/ml
Nitrik asidin yoğunluğu 1,51 g/mL’dir. Bir maddenin birim hacmi başına kütle miktarının ölçüsüdür. Nitrik asidin yoğunluğu, depolama ve taşıma gereksinimlerinin yanı sıra diğer maddelerle reaksiyona girme potansiyelinin belirlenmesine yardımcı olabilir.
Nitrik Asit Molekül Ağırlığı
Nitrik asidin moleküler ağırlığı 63.01 g/mol’dür. Moleküldeki tek tek atomların atom ağırlıklarının toplamıdır. Nitrik asidin moleküler ağırlığı, fiziksel ve kimyasal özelliklerinin belirlenmesinde önemli bir faktördür.
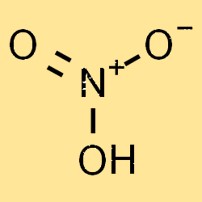
Nitrik asitin yapısı
Nitrik asit renksiz, oldukça reaktif ve uçucu bir sıvıdır. Moleküler yapısı bir nitrojen atomu, bir hidrojen atomu ve üç oksijen atomundan oluşur ve HNO3 kimyasal formülünü oluşturur. Oksijen atomları nitrojen atomunun etrafında üçgen düzlemsel bir düzende düzenlenmiştir.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 1,51 gr/ml |
| Renk | Renksiz |
| Koku | Keskin, keskin koku |
| Molar kütle | 63,01 g/mol |
| Yoğunluk | 1,51 gr/ml |
| Füzyon noktası | -41,5°C (-42,7°F) |
| Kaynama noktası | 83,0°C (181,4°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | karışabilir |
| çözünürlük | Alkol, eter ve diğer polar çözücülerde çözünür |
| Buhar basıncı | Oda sıcaklığında büyütüldü |
| Buhar yoğunluğu | 1,48 (hava = 1) |
| pKa | -1.3 |
| pH | 1 (%10’luk çözüm) |
Not: Nitrik asit sıvı olduğundan parlama noktası geçerli değildir. %10’luk nitrik asit çözeltisinin pH’ı 1’dir, bu da onun güçlü bir asit olduğunu gösterir. pKa, çözeltideki bir asidin kuvvetinin bir ölçüsü olan asit ayrışma sabitinin negatif logaritmasıdır.
Nitrik asidin güvenliği ve tehlikeleri
Nitrik asit, uygun şekilde kullanılmadığı takdirde ciddi yaralanmalara veya ölüme neden olabilecek son derece reaktif ve aşındırıcı bir maddedir. Bu yanıklara, göz hasarına ve solunum yolu tahrişine neden olabilir. Nitrik asitle çalışırken eldiven ve gözlük gibi uygun koruyucu ekipmanlar giyilmelidir. Depolama alanları iyi havalandırılmalı ve zehirli dumanların salınmasını önlemek için dökülen maddeler derhal temizlenmelidir. Cilt veya gözlerle teması halinde, etkilenen bölgeyi en az 20 dakika boyunca suyla yıkayın ve derhal tıbbi yardıma başvurun.
| Tehlike sembolleri | Çevre için tehlikeli, Oksitleyici, Zararlı, Tahriş edici |
| Güvenlik Açıklaması | S2 – Çocukların ulaşamayacağı yerde saklayın. S23 – Dumanını solumayın. S24/25 – Cilt ve gözlerle temasından kaçının. S26 – Gözle teması halinde derhal bol su ile yıkayın ve doktora başvurun. |
| BM kimlik numaraları | BM 2031 |
| HS kodu | 2811.90.90 |
| Tehlike sınıfı | 8 |
| Paketleme grubu | III |
| Toksisite | Yutulması ve solunması halinde çok toksiktir. Ciddi yanıklara ve göz hasarının yanı sıra solunum yolu tahrişine de neden olabilir. |
Nitrik asit sentez yöntemleri
Nitrik asit, aşağıdakiler de dahil olmak üzere çeşitli yöntemlerle sentezlenebilir:
- Ostwald işlemi: Bu yöntem, amonyağın hava ile oksitlenerek nitrik oksit oluşturulmasını ve bunun daha sonra nitrik asite oksitlenmesini içerir.
- Toluen Nitrasyonu: Bu yöntem, daha sonra nitrik asit oluşturmak üzere oksitlenen nitro-toluen oluşturmak için tolüenin nitrasyonunu içerir.
- Amonyum nitratın termal ayrışması: Bu yöntem, amonyum nitratın nitrik oksit üretmek için ısıtılmasını ve daha sonra nitrik asit oluşturmak üzere oksitlenmesini içerir.
- Amonyağın Doğrudan Oksidasyonu: Bu yöntem, nitrik asit üretmek için amonyağın oksijenle doğrudan oksidasyonunu içerir.
- Sodyum Nitrat Elektrolizi: Bu yöntem, nitrik asit üretmek için sodyum nitratın elektrolizini içerir.
Bu yöntemlerin etkinliği, maliyeti ve çevresel etkisi farklılık gösterir ve yöntemin seçimi, istenen son kullanıma ve üretim ölçeğine bağlıdır.
Nitrik Asitin Kullanım Alanları
Nitrik asit, aşağıdakiler de dahil olmak üzere çeşitli endüstrilerde geniş bir kullanım alanına sahiptir:
- Gübre: Nitrik asit, amonyum nitrat ve nitrik asit tuzları gibi azotlu gübrelerin üretiminde kullanılır.
- Farmasötikler: Nitrik asit, farmasötiklerin ve diğer kimyasal ara ürünlerin üretiminde reaktif olarak kullanılır.
- Patlayıcılar: Nitrik asit, dinamit ve nitroselüloz gibi patlayıcıların üretiminde kullanılır.
- Metal İşleme: Nitrik asit, çelik, bakır ve alüminyum da dahil olmak üzere metallerin dekapajı, temizlenmesi ve aşındırılması için kullanılır.
- Boyama ve Baskı: Boyama ve baskı işlemlerinde mordan olarak kullanılır.
- Su Arıtma: Nitrik asit, su arıtımında pH seviyelerini kontrol etmek ve yabancı maddeleri gidermek için kullanılır.
- Araştırma ve geliştirme: Nitrik asit, çeşitli kimyasal reaksiyonlar ve analizler için laboratuvar reaktifi olarak kullanılır.
Genel olarak nitrik asit, asidik ve oksitleyici özellikleri nedeniyle çok çeşitli uygulamalara sahiptir ve bu da onu çeşitli endüstriyel işlemlerde önemli bir kimyasal haline getirir.
Sorular:
Nitrik asit güçlü bir asit mi yoksa zayıf bir asit mi?
Evet, nitrik asit (HNO3) güçlü bir asit olarak kabul edilir. Güçlü asitler suda tamamen ayrışır ve hidrojen iyonları (H+) üretirler, bu da onların tamamen iyonize oldukları anlamına gelir. Buna karşılık, zayıf asitler suda yalnızca kısmen iyonlaşır, yani tamamen ayrışmazlar.
Nitrik asit çözeltisinde hemen hemen her molekül bir hidrojen iyonu vermiş olacak ve bu da onu güçlü bir proton donörü yapacaktır. Sonuç olarak nitrik asit yüksek konsantrasyonda hidrojen iyonuna ve düşük pH’a (genellikle 1-2 civarında) sahiptir. Bir asidin gücü, hidrojen iyonları verme yeteneği ile belirlenir ve nitrik asit, güçlü asitler listesindeki en güçlü asitlerden biridir.
Nitrik asidin (HNO3) güçlü bir oksitleyici etkiye sahip olduğunu ve ciddi yanık ve kimyasal reaksiyon riski oluşturduğunu unutmayın. Nitrik asidi dikkatli bir şekilde kullanın ve uygun koruyucu ekipman kullanın.
