NiCl2 olarak bilinen Nikel(II) klorür, yeşilimsi sarı bir kimyasal bileşiktir. Yaygın olarak elektrokaplamada, katalizörlerde ve diğer nikel bileşiklerinin sentezinde öncü olarak kullanılır.
| IUPAC’ın adı | Nikel(II) klorür |
| Moleküler formül | NiCl2 |
| CAS numarası | 7718-54-9 |
| Eş anlamlı | Nikel klorür, nikel diklorür, dikloronikel, nikel klorür |
| InChI | InChI=1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
Nikel klorürün özellikleri
Nikel Klorür Formülü
Nikel diklorürün formülü NiCl2’dir. Bu, her nikel diklorür molekülünün iki klor atomuna bağlı bir nikel atomundan oluştuğunu gösterir. Bu kimyasal formül, bileşikte bulunan elementlerin bileşimi ve oranı hakkında önemli bilgiler sağlar.
Nikel Klorür Molar Kütlesi
Kurucu elementlerin atomik kütlelerinin eklenmesiyle hesaplanan nikel diklorürün molar kütlesi, mol başına yaklaşık 129,6 gramdır. Bu değer, belirli bir numunede mevcut olan nikel diklorür miktarının belirlenmesinde ve çeşitli stokiyometrik hesaplamalarda faydalıdır.
Nikel klorürün kaynama noktası
Nikel diklorürün kaynama noktası yaklaşık 1,007 santigrat derecedir (1,845 Fahrenheit derece). Bu sıcaklıkta bileşik, sıvı halinden gaz haline faz geçişine uğrar. Kaynama noktası, ısıtıldığında nikel diklorürün davranışını anlamaya yardımcı olan önemli bir fiziksel özelliktir.
Nikel klorürün erime noktası
Nikel diklorürün erime noktası yaklaşık 1.002 santigrat derecedir (1.836 Fahrenheit derece). Bu, nikel diklorürün katı formunun sıvı duruma geçtiği sıcaklıktır. Erime noktası, nikel diklorürün taşınması ve işlenmesini içeren uygulamalar için önemlidir.
Nikel klorür yoğunluğu g/mL
Nikel diklorürün yoğunluğu mililitre başına yaklaşık 3,55 gramdır. Yoğunluk, bir maddenin birim hacmi başına kütlesinin bir ölçüsüdür ve malzemenin kompaktlığı hakkında bilgi sağlar. Nikel diklorürün yoğunluğu, çeşitli uygulamalardaki ve farklı fiziksel durumlardaki davranışının belirlenmesine yardımcı olur.
Nikel Klorür Molekül Ağırlığı
Nikel diklorürün moleküler ağırlığı mol başına yaklaşık 129,6 gramdır. Bileşikteki nikel ve klorun atomik kütlelerinin eklenmesiyle hesaplanır. Molekül ağırlığı, kimyasal reaksiyonlarda kütle, mol ve parçacık sayısı arasındaki ilişkileri anlamak için gereklidir.
Nikel klorürün yapısı
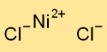
Nikel diklorür katı formunda kristal kafes yapısını benimser. Alternatif olarak düzenlenmiş nikel katyonlarından (Ni2+) ve klorür anyonlarından (Cl-) oluşur. Bu düzenleme, nikel diklorürün stabilitesine ve fiziksel özelliklerine katkıda bulunan üç boyutlu bir ağ oluşturur.
Nikel klorürün çözünürlüğü
Nikel diklorür suda orta derecede çözünürlüğe sahiptir. Yeşilimsi sarı bir çözelti oluşturacak şekilde çözünebilir. Nikel diklorürün çözünürlüğü sıcaklık ve diğer maddelerin varlığı gibi faktörlerden etkilenir. Çözünürlüğünü anlamak, çeşitli endüstriyel işlemlerde ve nikel diklorür içeren kimyasal uygulamalarda önemlidir.
| Dış görünüş | Yeşilimsi sarı katı |
| Spesifik yer çekimi | 3.55g/ml |
| Renk | yeşilimsi sarı |
| Koku | Kokusuz |
| Molar kütle | 129,6 g/mol |
| Yoğunluk | 3.55g/ml |
| Füzyon noktası | 1002°C (1836°F) |
| Kaynama noktası | 1007°C (1845°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Ilıman |
| çözünürlük | Organik çözücülerde (etanol, aseton) ve asitlerde çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Müsait değil |
| pH | Asit (yaklaşık 4) |
Nikel Klorür Güvenliği ve Tehlikeleri
Nikel diklorür dikkate alınması gereken bazı güvenlik riskleri taşır. Potansiyel risklerden kaçınmak için bu bileşiği dikkatli bir şekilde kullanmak önemlidir. Nikel diklorür ciltte tahrişe ve hassasiyete neden olabilir, bu nedenle kullanılırken eldiven ve koruyucu kıyafet giyilmelidir. Solunum yolu tahrişine neden olabileceğinden nikel diklorür tozunun veya buharının solunmasından kaçınılmalıdır. Nikel diklorürün yutulması zararlı olabilir ve bundan kaçınılmalıdır. Ek olarak nikel diklorür sudaki yaşam için toksiktir ve su kütlelerine salınması halinde çevreye zarar verebilir. Nikel diklorürle ilişkili riskleri en aza indirmek için uygun depolama, taşıma ve imha prosedürleri takip edilmelidir.
| Tehlike sembolleri | Aşındırıcı, zararlı, çevresel tehlike |
| Güvenlik Açıklaması | – Eldiven ve koruyucu kıyafet giyin – Toz veya buharı solumaktan kaçının – Yutmayı önleyin – Uygun şekilde saklayın, kullanın ve imha edin |
| Birleşmiş Milletler tanımlayıcıları | UN3288 |
| HS kodu | 2827.39.80 |
| Tehlike sınıfı | 8 (Aşındırıcı) |
| Paketleme grubu | III |
| Toksisite | Yutulması halinde zararlıdır, cilt ve göz tahrişine neden olur |
Nikel klorür sentez yöntemleri
Nikel diklorürü sentezlemek için her birinin kendine özgü avantajları ve uygulamaları olan çeşitli yöntemler vardır.
Yaygın bir yöntem, metalik nikel veya nikel oksidin hidroklorik asitle reaksiyonunu içerir. Bu işlemde metalik nikel veya nikel oksit uygun bir kaba eklenir ve yavaş yavaş hidroklorik asit eklenirken karıştırılır. Nikel ve asit arasındaki reaksiyon, nikel diklorürün yanı sıra hidrojen gazının salınmasını da üretir.
Başka bir sentez yöntemi, nikel karbonat ile hidroklorik asit arasındaki reaksiyonu içerir. Hidroklorik asit nikel karbonatı çözer ve ısıtılmış çözelti reaksiyona girerek nikel diklorür oluşturur ve karbondioksit gazı açığa çıkarır.
Hidroklorik asit, çözelti ısıtıldığında veya beklemeye bırakıldığında çözünmüş nikel hidroksit ile reaksiyona girerek nikel diklorürün sentezine neden olur. Reaksiyon nikel diklorür ve su oluşumuna yol açar.
Ek olarak nikel diklorür, metalik nikelin klor gazı ile reaksiyona sokulmasıyla hazırlanabilir. İki element arasındaki bu doğrudan reaksiyon nikel diklorürü verir.
Bu sentez yöntemleri, nikel diklorürün elde edilmesi için farklı yollar sunarak hammadde ve reaksiyon koşulları açısından esneklik sağlar. Yöntemin seçimi, nihai ürünün arzu edilen saflığı, ham maddelerin mevcudiyeti ve özel uygulama gereksinimleri gibi faktörlere bağlıdır.
Nikel Klorürün Kullanım Alanları
Nikel diklorürün benzersiz özellikleri nedeniyle farklı endüstrilerde çeşitli uygulamaları vardır. İşte dikkate değer kullanımlarından bazıları:
- Elektrokaplama: Elektrokaplama işlemlerinde genellikle çeşitli yüzeylerde koruyucu ve dekoratif bir kaplama sağlamak için nikel diklorür kullanılır. Nikel diklorür, korozyon direnci sağlarken çelik, pirinç ve bakır gibi metallerin görünümünü iyileştirir.
- Katalizör: Nikel diklorür, hidrojenasyon ve polimerizasyon işlemleri dahil olmak üzere birçok kimyasal reaksiyonda katalizör görevi görür. Reaktiflerin istenilen ürünlere dönüştürülmesini kolaylaştırır ve farmasötik, plastik ve sentetik elyaf üretiminde uygulama alanı bulur.
- Kimyasal sentez: Nikel diklorür, nikel oksit, nikel sülfür ve nikel siyanür gibi çeşitli nikel bileşiklerinin sentezinde öncü görevi görür. Endüstriler bu bileşikleri katalizörlerde, pigmentlerde, seramiklerde ve manyetik malzemelerde kullanır.
- Piller: Şarj edilebilir piller, özellikle nikel-metal hidrit (NiMH) piller, elektrolit olarak nikel diklorür kullanır. Şarj ve deşarj döngüleri sırasında iyonların elektrotlar arasında dolaşımını sağlar.
- Gaz Arıtma: Endüstriler, hidrojen sülfit ve karbon monoksit gibi safsızlıkları gidermek için gaz saflaştırma işlemlerinde nikel diklorür kullanır. Doğal gaz rafinasyonunda ve petrokimyasal işlemede uygulama alanı bulur.
- Hayvan Yemi Takviyesi: Hayvan yemi, özellikle kümes hayvanları ve domuz yemi, besin takviyesi olarak nikel diklorür içerir. Enzim aktivitesini kolaylaştırır ve hayvanların genel sağlığına ve büyümesine katkıda bulunur.
- Laboratuvar Araştırması: Araştırmacılar, nikel katalizli reaksiyonlar da dahil olmak üzere çeşitli laboratuvar deneylerinde ve kimyasal analiz için nikel iyonlarının kaynağı olarak nikel diklorürü kullanırlar.
Bu çeşitli uygulamalar, imalat ve enerjiden tarım ve araştırmaya kadar çeşitli sektörlerde nikel diklorürün çok yönlülüğünü ve önemini göstermektedir.
Sorular:
S: NiCl2’nin sulu çözeltisinde hangi iyonlar bulunur?
C: NiCl2’nin sulu bir çözeltisinde mevcut iyonlar Ni2+ (nikel katyonu) ve Cl-‘dir (klorür anyonu).
S: NiCl2 suda çözünür mü?
C: Evet, NiCl2 suda çözünür ve yeşilimsi sarı bir sulu çözelti oluşturur.
S: Hangi metal NiCl2(aq) ile kendiliğinden reaksiyona girer?
C: Magnezyum (Mg) ve çinko (Zn) gibi metaller, nikelin yerini almak ve ilgili klorürleri oluşturmak için kendiliğinden NiCl2(aq) ile reaksiyona girer.
S: NiCl2 polar mı yoksa polar değil mi?
C: NiCl2, nikel ve klor arasındaki elektronegatiflik farkından dolayı polar bir bileşiktir ve bu da eşit olmayan bir yük dağılımına neden olur.
S: NiCl2 sulu mu?
C: Evet, NiCl2 suda çözündüğünde sulu bir çözelti oluşturarak sulu bir halde bulunabilir.
Soru: NiCl2 formülüne sahip bileşiğin adı nedir?
C: NiCl2 formülüne sahip bileşiğe nikel(II) klorür denir.
S: 1,00 L 0,50 M NiCl2 çözeltisini nasıl hazırlarsınız?
A: 0,50 M NiCl2 çözeltisi hazırlamak için 129,6 gram NiCl2’yi suda çözün ve hacmi 1,00 L’ye yapın.
S: Na2S ve NiCl2 çözeltisi arasında oluşan çözünmeyen tuz nedir?
C: Bir Na2S çözeltisi NiCl2 ile karıştırıldığında çözünmeyen nikel sülfür (NiS) oluşur.
S: NiCl2(aq) katı mıdır?
C: Hayır, NiCl2(aq), NiCl2’nin sulu bir çözeltisini ifade eder, bu da onun sıvı formda olduğunu gösterir.
S: Kristalin nikel(II) klorürü yeşil yapan şey nedir?
C: Kristalin nikel(II) klorürün yeşil rengi, kristal kafesindeki nikel (Ni2+) katyonlarının varlığına atfedilir.
S: Nikel diklorür zehirli midir?
C: Evet, nikel diklorür zehirlidir ve dikkatle kullanılmalıdır. Cilt tahrişine ve solunum problemlerine neden olabilir ve yutulması halinde zararlıdır.
S: NiCl2 ve Na2S’nin sulu çözeltileri birleştirildiğinde reaksiyon meydana gelir mi?
C: Evet, NiCl2 ve Na2S’nin sulu çözeltileri birleştirildiğinde, çözünmeyen nikel sülfit (NiS) ve çözünür sodyum klorür (NaCl) oluşumuyla sonuçlanan bir reaksiyon meydana gelir.
S: 75,0 mL 0,555 M lityum hidroksiti nötralize etmek için kaç gram NiCl2 gereklidir?
A: Stokiyometrik bir reaksiyonda 75,0 ml 0,555 M lityum hidroksiti nötralize etmek için yaklaşık 18,4 gram NiCl2 gereklidir.
S: Amonyum karbonat, nikel diklorür ve suyu karıştırdığınızda ne olur?
C: Amonyum karbonat, nikel diklorür ve su karıştırıldığında, amonyum klorür, nikel karbonat ve suyun oluşmasıyla sonuçlanan bir reaksiyon meydana gelir.
