Sodyum nitrit (NaNO2), bakteriyel büyümeyi önlemek ve pastırma ve sosisli sandviç gibi kurutulmuş etlerin rengini ve lezzetini arttırmak için yaygın olarak gıda koruyucusu olarak kullanılan kimyasal bir bileşiktir.
| IUPAC Adı | Sodyum nitrat |
| Moleküler formül | NaNO2 |
| CAS numarası | 7632-00-0 |
| Eş anlamlı | Nitröz asit, sodyum tuzu; E250; Natriumnitrit; Sodyum nitrat; Sodyum nitrito; BM 1500 |
| InChI | InChI=1S/NO2.Na/c2-1-3;/q-1;+1 |
Sodyum nitritin özellikleri
Sodyum Nitrit Formülü
Sodyum nitritin kimyasal formülü NaNO2’dir. Bu, bir mol sodyum nitritin bir sodyum katyonu, bir nitrojen atomu ve iki oksijen atomu içerdiğini gösterir. Formül, bir maddenin bileşimini temsil etmek için kullanılır ve bir maddenin maruz kalabileceği reaksiyonları tahmin etmek için kullanılabilir.
Sodyum Nitrit Molar Kütlesi
NaNo2’nin molar kütlesi 69,0 g/mol’dür. Bu, bileşiğin 6,02 x 10^23 ayrı molekülünü içeren madde miktarı olan bir mol NaNo2’nin kütlesidir. Molar kütle, bir maddenin çeşitli kimyasal ve fiziksel özelliklerini hesaplamak için kullanılan önemli bir fiziksel özelliktir.
Sodyum nitritin kaynama noktası
NaNo2’nin kaynama noktası 320°C’dir (608°F). Bu, NaNo2’nin sıvıdan gaza dönüşeceği sıcaklıktır. Kaynama noktası önemli bir özelliktir çünkü bir maddenin boya, pigment ve ilaç üretimi gibi çeşitli endüstriyel uygulamalarda nasıl kullanıldığını etkileyebilir.
Sodyum nitrit Erime noktası
NaNo2’nin erime noktası 271°C’dir (520°F). Bu, NaNo2’nin katıdan sıvıya dönüşeceği sıcaklıktır. Erime noktası önemli bir özelliktir çünkü bir maddenin farklı sıcaklıklarda stabilitesini ve reaktivitesini etkileyebilir.
Sodyum nitritin yoğunluğu g/mL
NaNo2’nin yoğunluğu 2,168 g/mL’dir. Yoğunluk, bir maddenin birim hacmi başına kütlesidir ve bir çözeltinin konsantrasyonunu belirlemek için kullanılabilir. NaNo2 yoğunluğu aynı zamanda bir numunenin saflığını belirlemek için de kullanılabilir.
Sodyum Nitrit Molekül Ağırlığı
NaNo2’nin moleküler ağırlığı 69,0 g/mol’dür. Bir bileşiğin molekülündeki tüm atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı, bir maddenin çeşitli kimyasal ve fiziksel özelliklerini hesaplamak için kullanılan önemli bir özelliktir.
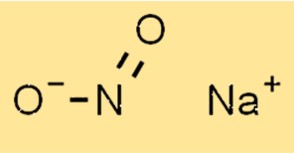
Sodyum nitritin yapısı
NaNo2’nin yapısı bir sodyum katyonu (Na+) ve bir nitrit anyonundan (NO2-) oluşur. Nitrit anyonu, bir nitrojen atomu ve iki oksijen atomundan oluşan trigonal düzlemsel bir geometriye sahiptir. Sodyum katyonu nitrit anyonunun merkezinde bulunur.
Sodyum nitritin çözünürlüğü
NaNo2, 20°C’de 820 g/L çözünürlükle suda çözünür. Çözünürlük, belirli bir sıcaklıkta belirli miktarda çözücü içinde çözülebilen maksimum madde miktarıdır. NaNo2’nin çözünürlüğü sıcaklık ve diğer çözünen maddelerin varlığı gibi faktörlerden etkilenebilir.
| Dış görünüş | Beyaz ila hafif sarımsı kristal toz |
| Spesifik yer çekimi | 2.168 g/mL |
| Renk | Beyaz ila hafif sarımsı |
| Koku | Kokusuz |
| Molar kütle | 69,0 g/mol |
| Yoğunluk | 2.168 g/mL |
| Füzyon noktası | 271°C (520°F) |
| Kaynama noktası | 320°C (608°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 820 g/L |
| çözünürlük | Etanol ve gliserolde çözünür |
| Buhar basıncı | 20°C’de 1,33 kPa |
| Buhar yoğunluğu | 2,3 (hava = 1) |
| pKa | 3.34 |
| pH | 7-8 (%10’luk çözüm) |
Sodyum Nitritin Güvenliği ve Tehlikeleri
NaNo2 insan sağlığına ve çevreye birçok tehlike oluşturabilir. Yutulması, solunması veya deriden emilmesi halinde toksik kabul edilir ve kanın vücut dokularına oksijen taşıyamadığı bir durum olan methemoglobinemiye neden olabilir. NaNo2 ayrıca gözleri, cildi ve solunum sistemini tahriş edebilir. NaNo2’nin dikkatli bir şekilde, uygun kişisel koruyucu ekipman kullanılarak ve uygun taşıma ve imha prosedürleri takip edilerek kullanılması önemlidir. Ayrıca NaNo2, uygun şekilde muhafaza edilip imha edilmediği takdirde çevre için risk oluşturabilir.
| Tehlike sembolleri | T+,C |
| Güvenlik Açıklaması | Yanıcı malzemelerden uzak tutun. Tozunu/dumanını/gazını/sisini/buharını/spreyini solumayın. Koruyucu eldiven/kıyafet ve göz/yüz koruması kullanın. Yangın durumunda: Söndürmek için CO2, kimyasal toz veya köpük kullanın. İçeriği/kabı yerel/bölgesel/ulusal/uluslararası düzenlemelere uygun olarak atın. |
| BM kimlik numaraları | UN1500 |
| HS kodu | 283410 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | Yutulması, solunması ve cilt tarafından emilmesi halinde çok toksiktir. Methemoglobinemiye neden olabilir. Gözleri, cildi ve solunum sistemini tahriş eder. |
Sodyum nitritin sentezi için yöntemler
NaNo2’yi sentezlemek için çeşitli yöntemler vardır.
Yaygın bir yöntem, sodyum nitrat üreten nitrik asit ve sodyum hidroksitin reaksiyona sokulmasıdır. Demir veya çinko gibi bir indirgeyici madde, sodyum nitratı indirgeyerek NaNo2 oluşturur.
Başka bir yöntem , sodyum nitratın hidroklorik asit ile reaksiyona girerek bir nitrik asit ve sodyum klorür karışımı üretmesini içerir. Sodyum hidroksit nitrik asitle reaksiyona girerek NaNo2 üretir.
NaNo2 sentezi, ürün olarak NaNo2 ve su üreten amonyak ve sodyum nitrat arasındaki reaksiyon yoluyla meydana gelebilir.
Nitrik asit üretim prosesi, proseste amonyağı oksitlerken yan ürün olarak NaNo2 üretir.
Sodyum nitritin kullanım alanları
NaNo2’nin çeşitli endüstrilerde çeşitli kullanımları vardır; bunlardan bazıları şunlardır:
- Gıdaların Korunması: Özellikle pastırma ve sosisli sandviç gibi kurutulmuş etlerde yaygın olarak gıda koruyucu olarak kullanılır. Zararlı bakterilerin üremesini engellemeye yardımcı olur ve etin rengini ve lezzetini korur.
- Endüstriyel Uygulamalar: Metal işleme ve korozyon önleyici olarak çeşitli endüstriyel uygulamalarda kullanılır. Ayrıca boya ve diğer kimyasalların üretiminde de kullanılır.
- Tıbbi Uygulamalar: Tıbbi olarak siyanür zehirlenmesini tedavi etmek için kullanılır çünkü hemoglobini, siyanür iyonlarına bağlanabilen ve bunların hemoglobine bağlanmasını önleyebilen methemoglobine dönüştürür.
- Su Arıtma: Su sistemlerinde zararlı bakteri ve alglerin büyümesini kontrol etmek için su arıtımında kullanılır.
- Tarım: Tarımda gübre olarak kullanılır, ürün verimini ve kalitesini artırmaya yardımcı olur.
- Fotoğrafçılık: Fotoğrafçılıkta geliştirici bir ajan olarak kullanılır.
Sorular:
S: Sodyum nitrit nedir?
C: NaNo2, NaNO2 formülüne sahip kimyasal bir bileşiktir. Gıda koruyucu olarak ve çeşitli endüstriyel uygulamalarda yaygın olarak kullanılan beyaz veya hafif sarımsı kristal tozdur.
S: Sodyum nitriti kim keşfetti?
C: NaNO2 ilk kez 1805 yılında Fransız kimyager Louis Nicolas Vauquelin tarafından keşfedildi.
S: Sodyum nitrit sizin için kötü mü?
C: Aşırı NaNo2 tüketimi insan sağlığına zararlı olabilir. Kanser ve kanın oksijeni etkili bir şekilde taşıyamadığı bir hastalık olan methemoglobinemi gibi sağlık sorunlarıyla bağlantılıdır. Ancak düzenlenmiş ve sınırlı miktarlarda kullanıldığında NaNo2’nin tüketim için güvenli olduğu düşünülmektedir.
S: Sodyum nitritin formülü nedir?
C: Sodyum nitritin formülü NaNO2’dir.
S: Sodyum nitrit güvenli midir?
C: NaNo2’nin, düzenlenmiş ve sınırlı miktarlarda kullanıldığında tüketim için genellikle güvenli olduğu kabul edilir. Ancak aşırı tüketimi insan sağlığına zararlı olabilir.
S: Sodyum nitrit nasıl yapılır?
C: NaNo2, nitrik asit ve sodyum hidroksitin reaksiyonu, sodyum nitratın hidroklorik asit ile reaksiyonu ve amonyağın sodyum nitrat ile reaksiyonu gibi çeşitli yöntemlerle sentezlenebilir. Ancak NaNo2 sentezi, tehlikeli kimyasalların kullanımını içerdiğinden ve uygun güvenlik önlemlerinin alınmasını gerektirdiğinden dikkatli bir şekilde gerçekleştirilmelidir.
S: Sodyum nitrit oksidan mıdır?
C: Evet, NaNo2 bir oksidandır. Piroteknikte oksitleyici bir madde olarak yaygın olarak kullanılır.
S: Sodyum nitrit etin rengini nasıl etkiler?
C: NaNO2 genellikle pastırma ve sosisli sandviç gibi kurutulmuş etlerde gıda koruyucusu olarak kullanılır. Renk bozulmasına neden olabilecek zararlı bakterilerin gelişimini engelleyerek etin renginin korunmasına yardımcı olur.
S: NaNO2 ve NaNO3 ticari olarak nasıl üretilir?
C: NaNO3 ve NaNO2, amonyağın oksidasyonu ve sodyum hidroksitin nitrik asitle reaksiyonu gibi çeşitli yöntemlerle ticari olarak üretilir. Çeşitli endüstriyel, tıbbi ve tarımsal uygulamaların yanı sıra gıda muhafazasında da kullanılırlar.
