Magnezyum oksit (MgO), yapı malzemesi ve besin takviyesi olarak kullanılan beyaz toz halinde bir katıdır. Ayrıca bazik (alkali) özelliklerinden dolayı antiasit olarak da kullanılır.
| IUPAC Adı | Magnezyum oksit |
| Moleküler formül | MgO |
| CAS numarası | 1309-48-4 |
| Eş anlamlı | Magnezya, Manyezit, Periklaz |
| InChI | InChI=1S/MgO/c1-2 |
Magnezyum Oksit Formülü
Magnezyum oksidin kimyasal formülü MgO’dur. Bir magnezyum iyonunu (Mg2+) ve bir oksijen iyonunu (O2-) temsil eder. Formül, bileşikte bulunan elementlerin oranını gösterir ve magnezyum oksit içeren reaksiyonlar için dengeli kimyasal denklemler yazmak için kullanılır.
Magnezyum Oksit Molar Kütlesi
Magnezyum oksidin molar kütlesi 40.304 g/mol’dür. Bileşikte bulunan her bir elementin atomik kütlelerinin eklenmesiyle hesaplanır. Magnezyumun atom kütlesi 24.305 g/mol, oksijeninki ise 16.000 g/mol’dür. Molar kütle, belirli bir magnezyum oksit numunesinde bulunan madde miktarının belirlenmesinde önemlidir.
Magnezyum oksidin kaynama noktası
Magnezyum oksidin kaynama noktası 2852°C’dir. Bu sıcaklıkta katının buhar basıncı atmosfer basıncına eşit olur ve kaynamaya başlar. Magnezyum oksidin yüksek kaynama noktası, kafes yapısındaki iyonları ayırmak için büyük miktarda enerji gerektiren iyonik yapısından kaynaklanmaktadır.
Magnezyum Oksit Erime Noktası
Magnezyum oksidin erime noktası 2800°C’dir. Bu sıcaklıkta katı hal sıvıya dönüşür. Magnezyum oksidin yüksek erime noktası aynı zamanda iyonik yapısından ve ağ yapısındaki iyonlar arasındaki güçlü bağlardan kaynaklanmaktadır.
Magnezyum oksit yoğunluğu g/mL
Magnezyum oksidin yoğunluğu 3,58 g/mL’dir. Bu değer, belirli bir magnezyum oksit kütlesinin kapladığı alan miktarını belirlemek için kullanılabilir. Bileşiğin karakteristik bir özelliğidir ve çeşitli uygulamalarda faydalıdır.
Magnezyum Oksit Molekül Ağırlığı
Magnezyum oksidin moleküler ağırlığı 40.304 g/mol’dür. Bileşikte bulunan her bir elementin atom ağırlıklarının toplamıdır. Molekül ağırlığı, belirli bir magnezyum oksit örneğinde bulunan madde miktarının belirlenmesinde önemlidir.
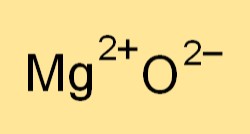
Magnezyum oksidin yapısı
Magnezyum oksit, magnezyum iyonlarının oksijen iyonları ile çevrelendiği bir kristal kafes yapısına sahiptir. Magnezyum ve oksijen iyonları, bileşiğin yüksek erime ve kaynama noktalarına katkıda bulunan güçlü iyonik bağlarla bir arada tutulur. Kristal yapı, magnezyum oksidin yoğunluğu ve termal iletkenliği gibi özelliklerinin belirlenmesinde önemli bir faktördür.
| Dış görünüş | Beyaz toz halinde katı |
| Spesifik yer çekimi | 3.58g/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 40.304 gr/mol |
| Yoğunluk | 3.58g/ml |
| Füzyon noktası | 2800°C |
| Kaynama noktası | 2852°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünmez |
| çözünürlük | Asitte çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Alkali (temel) |
Magnezyum Oksit Güvenliği ve Tehlikeleri
Magnezyum oksit genellikle önerilen dozlarda insan tüketimi için güvenli kabul edilir ve besin takviyesi ve antiasit olarak kullanılır. Bununla birlikte, yüksek konsantrasyonda magnezyum oksit tozunun solunması solunum yolu tahrişine neden olabilir ve uzun süreli maruz kalma akciğer hasarına yol açabilir. Büyük miktarda magnezyum oksidin yutulması ishale, mide bulantısına ve karın rahatsızlığına neden olabilir. Tozun solunmasını önlemek için magnezyum oksidin kuru, iyi havalandırılan bir alanda saklanması önemlidir. Tahrişe neden olabileceğinden magnezyum oksitin cilt ve gözle temasından kaçının. Tüm kimyasallarda olduğu gibi, magnezyum oksitle çalışırken yaralanma riskini en aza indirmek için uygun kullanım ve güvenlik prosedürlerinin takip edilmesi önemlidir.
| Tehlike sembolleri | Yok |
| Güvenlik Açıklaması | S26-S36/37/39 |
| BM kimlik numaraları | UN3077, Çevreye zararlı maddeler, katı, nos (magnezyum oksit) |
| HS kodu | 2825.90.90 |
| Tehlike sınıfı | 9 |
| Paketleme grubu | III |
| Toksisite | Önerilen dozlarda yutulursa düşük toksisite, yüksek konsantrasyonlarda solunması halinde solunum yolu tahrişine neden olabilir |
Magnezyum Oksit Sentez Yöntemleri
Magnezyum oksit (MgO), termal ayrışma, çökeltme ve sol-jel işlemleri dahil olmak üzere çeşitli yöntemlerle sentezlenebilir.
Kalsinasyon olarak da bilinen termal ayrışma, MgO üretmek için magnezyum karbonatın veya hidroksitin yüksek sıcaklıklarda ısıtılmasını içerir. Bu yöntem, refrakter malzemelerin üretiminde ve ayrıca ilaç ve kimya endüstrileri için yüksek saflıkta MgO sentezinde yaygın olarak kullanılmaktadır.
Yağış, MgO’yu sentezlemenin başka bir yöntemidir. Bu yöntem, magnezyum klorür veya sülfat gibi magnezyum tuzlarının, MgO oluşturmak üzere sodyum hidroksit veya potasyum hidroksit gibi bir alkalin çözeltiyle reaksiyona sokulmasını içerir. Çöken MgO daha sonra filtrelenebilir, yıkanabilir ve kurutularak saf bir ürün elde edilebilir.
Sol-jel prosesleri, MgO oluşturmak üzere magnezyum alkoksitler gibi magnezyum öncüllerinin hidrolizini ve yoğunlaşmasını içerir. Bu yöntem, tekdüze parçacık boyutuna ve iyi tanımlanmış kristal yapıya sahip MgO üretme avantajını sunarak katalizör, seramik ve elektronik endüstrilerindeki uygulamalar için kullanışlı hale getirir.
Genel olarak MgO’yu sentezleme yöntemi, istenen saflığa, parçacık boyutuna ve kristal yapısına ve ayrıca MgO ürününün amaçlanan uygulamasına bağlı olacaktır. Sentez yöntemi ne olursa olsun, yabancı maddelerin oluşumunu önlemek ve yüksek kaliteli bir MgO ürünü elde etmek için reaksiyon koşullarının dikkatli bir şekilde kontrol edilmesi önemlidir.
Magnezyum Oksit Kullanım Alanları
Magnezyum oksit (magnezyum oksit), kimyasal stabilitesi, yüksek ısı iletkenliği ve elektriksel yalıtım özellikleri nedeniyle geniş bir uygulama alanına sahiptir. Magnezyum oksitin en yaygın kullanımlarından bazıları şunlardır:
- Magnezyum oksit (MgO), kimyasal stabilitesi, yüksek ısı iletkenliği ve elektriksel yalıtım özellikleri nedeniyle geniş bir kullanım alanına sahiptir.
- İnşaat ve inşaat endüstrileri, MgO’yu yangına dayanıklı malzeme olarak ve refrakter malzemelerin üretiminde kullanmaktadır.
- İlaç endüstrisi, MgO’yu besin takviyesi olarak ve mide asidini nötralize etmek için antasit olarak kullanır.
- MgO, magnezyum hidroksit ve magnezyum karbonat gibi diğer magnezyum bileşiklerinin üretiminde magnezyum kaynağı olarak görev yapar.
- Kimya endüstrisi, sentetik kauçuk, plastik ve reçine üretimi de dahil olmak üzere çeşitli reaksiyonlarda MgO’yu katalizör olarak kullanır.
- Tarım endüstrileri, toprak verimliliğini artırmak ve bitki büyümesi için gerekli magnezyumu sağlamak için toprak iyileştirici olarak MgO’yu kullanır.
- MgO’nun ağır metalleri ve toksik maddeleri adsorbe etme yeteneği, onu çevresel iyileştirme için faydalı kılar.
- Seramik sektörü, seramik, elektrik yalıtkanları, refrakter malzemeler ve yüksek sıcaklık yalıtımı üretiminde hammadde olarak MgO’yu kullanmaktadır.
- Elektronik endüstrisi, yüksek dielektrik sabiti ve düşük kayıp tanjantı nedeniyle kapasitör ve transistör gibi elektronik cihazların üretiminde MgO kullanır.
Genel olarak magnezyum oksit, kimyasal ve fiziksel özelliklerin benzersiz kombinasyonu nedeniyle birçok uygulamaya sahip çok yönlü bir malzemedir.
Sorular:
Magnezyum oksit gibi bir bileşiği en iyi ne tanımlar?
Magnezyum oksit (MgO) iyonik bir bileşik olarak oluşur.
Metalik magnezyum, metalik olmayan oksijene elektron vererek pozitif yüklü magnezyum iyonları (Mg2+) ve negatif yüklü oksit iyonları (O2-) oluşturur. Bu iyonlar güçlü elektrostatik çekim yoluyla iyonik olarak bağlanarak katı bir kristal yapı oluşturur.
İyonik bileşikler yüksek erime ve kaynama noktalarına, oda sıcaklığında katılığa, erimiş veya çözünmüş halde iyi elektrik iletkenliğine ve çoğu çözücüde çözünmezliğe sahiptir. Bu özellikler iyonik bileşikleri, kovalent bağlanma ile oluşan ve daha düşük erime ve kaynama noktalarına, zayıf elektrik iletkenliğine ve birçok çözücüde çözünürlüğe sahip moleküler bileşiklerden ayırır.
Yapı malzemesi olarak hangi iyonik bileşik kullanılır? kireçtaşı tuz magnezyum oksit demir oksit
Tuzlu kireçtaşı iyonik bir bileşik değildir, ancak magnezyum oksit ve demir oksit iyonik bir bileşiktir.
Yapı malzemesi olarak magnezyum oksit (MgO) ve demir oksit kullanılır. MgO yanmaz duvarlar ve bölmeler oluşturur ve yüksek sıcaklık uygulamaları için refrakter malzemelerde bir bileşen olarak hizmet eder. Hematit olarak da bilinen demir oksit, pigment olarak tuğla, beton ve seramiğe kırmızımsı kahverengi bir renk verir. Hematit ayrıca kimyasal reaksiyonlarda katalizör görevi görür ve çeşitli teknolojilerde manyetik malzeme olarak görev yapar.
