Magnezyum sülfit (MgSO3), magnezyum ve sülfit iyonlarından oluşan bir bileşiktir. Gıda endüstrisinde gıda koruyucu ve antioksidan olarak yaygın olarak kullanılır.
| IUPAC Adı | Magnezyum sülfit |
| Moleküler formül | MgSO3 |
| CAS numarası | 7757-88-2 |
| Eş anlamlı | Magnezyum sülfonat, magnezyum sülfür trioksit, E-536 |
| InChI | InChI=1S/Mg.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Magnezyum sülfitin özellikleri
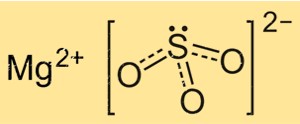
Magnezyum Sülfit Formülü
Magnezyum sülfit, bir magnezyum atomu, bir kükürt atomu ve üç oksijen atomundan oluştuğunu gösteren MgSO3 kimyasal formülüne sahiptir. Sülfit iyonu, üç oksijen atomuna bağlı merkezi bir kükürt atomundan oluşan, SO32- formülüne sahip çok atomlu bir iyondur. Mg iyonunun yükü +2 iken SO3 2- iyonunun yükü -2’dir, bu da bileşiği elektriksel olarak nötr kılar.
Magnezyum Sülfit Molar Kütlesi
MgSO3’ün molar kütlesi 104,37 g/mol’dür; bu, bir magnezyum atomu, bir kükürt atomu ve üç oksijen atomunun atomik kütlelerinin toplamına karşılık gelir. Bu değer, belirli bir reaksiyon için gereken MgSO3 miktarının hesaplanması ve kimyasal denklemlerin stokiyometrisinin belirlenmesi için önemlidir.
Magnezyum sülfitin kaynama noktası
MgSO3 kaynama noktasına ulaşmadan ayrıştığı için belirli bir kaynama noktası yoktur. Bunun yerine 700°C’nin üzerindeki sıcaklıklarda magnezyum oksit ve kükürt dioksite parçalanmaya başlar. Bu ayrışma süreci havaya veya neme maruz bırakılarak hızlandırılabilir, bu da MgSO3’ü nispeten kararsız bir bileşik haline getirir.
Magnezyum sülfit Erime noktası
MgSO3’ün erime noktası yaklaşık 150°C’dir. Bu sıcaklıkta bileşik, magnezyum oksit ve kükürt dioksite ayrışmaya başlar. Ayrışma süreci ekzotermiktir, yani ısı açığa çıkar. MgSO3’ün erime noktası, çözünürlüğü ve kristal yapısı gibi katı özelliklerini anlamak için önemlidir.
Magnezyum sülfitin yoğunluğu g/mL
MgSO3’ün yoğunluğu fiziksel formuna bağlı olarak değişmekle birlikte genel olarak 2,5 ila 3,0 g/mL aralığındadır. Bu değer, belirli bir MgSO3 hacminin kütlesini belirlemek ve çözeltideki davranışını anlamak için önemlidir. MgSO3’ün yoğunluğu, suya kıyasla bağıl yoğunluğunun bir ölçüsü olan yoğunluğunu hesaplamak için de kullanılabilir.
Magnezyum Sülfit Molekül Ağırlığı
MgSO3’ün moleküler ağırlığı 104,37 g/mol’dür. Bu değer, bileşiğin fiziksel ve kimyasal özelliklerinin anlaşılmasının yanı sıra belirli bir reaksiyon için gerekli MgSO3 miktarının hesaplanması açısından da önemlidir. MgSO3’ün moleküler ağırlığı, bir magnezyum atomu, bir kükürt atomu ve üç oksijen atomunun atom ağırlıkları toplanarak hesaplanabilir.
Magnezyum sülfitin yapısı
MgSO3’ün yapısı, Mg+2 iyonları ve SO3 2- iyonlarından oluşan bir kristal kafese dayanmaktadır. Mg+2 iyonları oktahedral olarak düzenlenmiş altı oksijen atomuyla çevrelenirken, SO3 2-iyonları magnezyum iyonlarına iki oksijen atomu aracılığıyla bağlanır. MgSO3’ün kristal yapısı, çözünürlüğü ve reaktivitesi gibi fiziksel ve kimyasal özelliklerinin anlaşılması açısından önemlidir.
Magnezyum sülfitin çözünürlüğü
MgSO3 suda çok az çözünür ve oda sıcaklığında yaklaşık 7,5 g/L’lik bir çözünürlüğe sahiptir. Bu düşük çözünürlük, bileşiğin kristal yapısından kaynaklanmaktadır, bu da su moleküllerinin katıya nüfuz etmesini ve çözünmesini zorlaştırmaktadır. MgSO3 asidik çözeltilerde daha fazla çözünür çünkü asit, sülfit iyonu ile reaksiyona girerek bisülfit ve sülfürik asit oluşturabilir. MgSO3’ün çözünürlüğü, çözelti içindeki davranışını anlamak ve aynı zamanda bir gıda koruyucusu ve antioksidan olarak etkinliğini belirlemek için önemlidir.
| Dış görünüş | Beyaz toz veya kristaller |
| Spesifik yer çekimi | 2,5 – 3,0 |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 104,37 gr/mol |
| Yoğunluk | 2,5 ila 3,0 g/ml |
| Füzyon noktası | 150°C civarında |
| Kaynama noktası | 700°C’nin üzerinde ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Az çözünür, oda sıcaklığında yaklaşık 7,5 g/L |
| çözünürlük | Asidik çözeltilerde daha fazla çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Magnezyum Sülfitin Güvenliği ve Tehlikeleri
MgSO3 çok tehlikeli bir madde olarak kabul edilmez. Ancak temas veya solunması halinde gözlerde, ciltte ve solunum yollarında tahrişe neden olabilir. MgSO3’ün yutulması mide-bağırsak tahrişine ve muhtemelen kusmaya neden olabilir. Yüksek konsantrasyonlara uzun süre maruz kalmak akciğer hasarına veya solunum yolu tahrişine neden olabilir. Bu nedenle MgSO3’ü dikkatli bir şekilde kullanmak, uygun kişisel koruyucu ekipman giymek ve toz veya dumanların solunmasından kaçınmak önemlidir. MgSO3 serin, kuru, iyi havalandırılmış bir alanda, güçlü oksidanlar, asitler ve bazlar gibi uyumsuz malzemelerden uzakta depolanmalıdır.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Toz veya dumanları solumaktan kaçının. Uygun kişisel koruyucu ekipman giyin. |
| BM kimlik numaraları | Düzenlenmemiş |
| HS kodu | 2833.29 |
| Tehlike sınıfı | Tehlikeli olarak sınıflandırılmadı |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük toksisite, temas veya solunması halinde gözler, cilt ve solunum yollarında tahrişe neden olabilir. Yutma, mide-bağırsak tahrişine ve muhtemelen kusmaya neden olabilir. Yüksek konsantrasyonlara uzun süre maruz kalmak akciğer hasarına veya solunum yolu tahrişine neden olabilir. |
Magnezyum sülfit sentez yöntemleri
MgSO3, sülfürik asit veya sülfür dioksit gazının magnezyum oksit veya magnezyum hidroksit ile reaksiyonu gibi çeşitli yöntemlerle sentezlenebilir.
Bir yöntemde, magnezyum oksidin suyla reaksiyonu magnezyum hidroksiti oluşturur ve bu daha sonra sülfürik asitle reaksiyona girerek MgS03 üretir.
Başka bir yöntem, MgS03 oluşturmak için magnezyum hidroksitin su varlığında kükürt dioksit gazı ile reaksiyona sokulmasını içerir.
Başka bir yöntemde, magnezyum sülfatın sodyum sülfit veya potasyum sülfit ile reaksiyona sokulması MgS03’ü sentezleyebilir. Bu reaksiyon, araştırmacıların filtreleme ve kurutma yoluyla izole edebileceği bir MgSO3 çökeltisi üretir.
Magnezyum asetatın su varlığında kükürt dioksit gazı ile reaksiyonu MgSO3 hazırlayabilir. Daha sonra elde edilen MgSO3 çökeltisini yıkayıp kurutun.
Bu yöntemler, kağıt ve kağıt hamuru üretimi, yiyecek ve içecek işleme ve su arıtma dahil olmak üzere çeşitli uygulamalara yönelik MgSO3 üretmek için kullanılabilir.
Magnezyum Sülfitin Kullanım Alanları
MgSO3’ün farklı endüstrilerde çeşitli kullanımları vardır. Yaygın kullanımlarından bazıları şunlardır:
- Su Arıtma: Kazan suyu arıtımında korozyon ve kireç oluşumunu önlemek amacıyla oksijen tutucu olarak kullanılır.
- Yiyecek ve içecek işleme: Yiyecek ve içecek işlemede raf ömrünü uzatmak ve bozulmayı önlemek için koruyucu ve antioksidan olarak kullanılır.
- Kağıt Hamuru ve Kağıt Üretimi: Kağıt hamuru ve kağıt endüstrisinde, kağıt ürünlerinin parlaklığını ve rengini iyileştirmek amacıyla ağartma maddesi olarak kullanılır.
- Tekstil imalatı: Tekstil imalatında fazla oksijeni uzaklaştırmak ve bitmiş ürünün kalitesini arttırmak için indirgeyici madde olarak kullanılır.
- Tarım: Bitki büyümesini iyileştirmek ve mahsul verimini arttırmak için yaprak spreyi olarak kullanılır.
- Tıp: Geleneksel tıpta antioksidan ve antiinflamatuar özellikleri nedeniyle kullanılır.
- Kozmetik: Kozmetikte emülgatör, stabilizatör ve pH ayarlayıcı olarak kullanılır.
- Diğer kullanım alanları: Ayrıca yapıştırıcı, boya ve kaplama üretiminde ve atık su arıtma proseslerinde de kullanılır.
Sorular:
S: Magnezyum sülfitin formülü nedir?
C: Magnezyum sülfitin formülü MgSO3’tür.
S: 2,4 mol numunede ne kadar magnezyum sülfit bulunur?
A: 2,4 mol MgSO3 örneğinde 2,4 mol MgSO3 vardır.
Soru: 1 mol magnezyum sülfitteki her bir elementin kütle yüzdesi nedir?
C: Bir mol magnezyum sülfitte magnezyumun kütle yüzdesi %32,44, kükürt %29,44 ve oksijen %38,12’dir.
Soru: Magnezyum sülfit kas kramplarını durdurur mu?
C: MgSO3’ün kas kramplarını durdurabildiğini gösteren hiçbir bilimsel kanıt yoktur. Ancak bu amaçla magnezyum sülfat (Epsom tuzu) kullanılmıştır.
S: Reaksiyonlara magnezyum sülfit eklemenin etkisi nedir?
C: MgSO3 ilavesi, belirli reaksiyonlarda oksijeni uzaklaştırarak indirgeyici bir madde olarak görev yapabilir. Ayrıca bazı uygulamalarda koruyucu ve antioksidan görevi de görebilir.
S: Magnezyum sülfit iyonik mi yoksa moleküler mi?
C: MgSO3 iyonik bir bileşiktir.
