Magnezyum sülfat (sülfat) veya MgSo4, magnezyum, kükürt ve oksijenden oluşan kimyasal bir bileşiktir. Tıbbi olarak müshil, antikonvülsan olarak ve magnezyum eksikliğini tedavi etmek için yaygın olarak kullanılır.
| IUPAC Adı | Magnezyum sülfat |
| Moleküler formül | MgSO4 |
| CAS numarası | 7487-88-9 |
| Eş anlamlı | Epsom tuzu; İngiliz tuzu; Acı tuz; Banyo tuzu; Epsom tuzu; Sal anglicum; Magnezyum sülfat heptahidrat |
| InChI | InChI=1S/Mg.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Magnezyum sülfat formülü
Magnezyum sülfatın kimyasal formülü MgSO4’tür. Bu formül, magnezyum sülfatın bir magnezyum katyonu (Mg2+) ve bir sülfat anyonundan (SO42-) oluştuğunu gösterir. Magnezyum sülfat formülü kimyasal hesaplamalarda önemlidir çünkü kimyasal reaksiyonda ihtiyaç duyulan madde miktarının belirlenmesine yardımcı olur.
MgSO4 molar kütlesi
Magnezyum sülfatın molar kütlesi 120.366 g/mol’dür. Bu değer, bir magnezyum atomu (24.305 g/mol), bir kükürt atomu (32.066 g/mol) ve dört oksijen atomunun (her biri 15.999 g/mol) atomik kütlelerinin eklenmesiyle hesaplanır. Molar kütle, kimyasal hesaplamalarda önemli bir parametredir çünkü kimyasal reaksiyonda gerekli olan madde miktarının belirlenmesine yardımcı olur.
Magnezyum sülfatın kaynama noktası
Magnezyum sülfatın kaynama noktası bileşiğin durumuna bağlıdır. Magnezyum sülfat susuz ve heptahidrat olmak üzere iki formda bulunur. Susuz form 1,124 °C (2,055 °F) gibi daha yüksek bir kaynama noktasına sahipken, heptahidrat form 150 °C (302 °F) gibi daha düşük bir kaynama noktasına sahiptir. Magnezyum sülfatın kaynama noktası, basınç ve yabancı maddeler gibi faktörlerden etkilenebilir.
Magnezyum sülfatın erime noktası
Magnezyum sülfatın erime noktası aynı zamanda bileşiğin durumuna da bağlıdır. Susuz form, 1,124 °C (2,055 °F) gibi daha yüksek bir erime noktasına sahipken, heptahidrat form, 150 °C (302 °F) gibi daha düşük bir erime noktasına sahiptir. Magnezyum sülfatın erime noktası aynı zamanda basınç ve yabancı maddeler gibi faktörlerden de etkilenebilir.
Magnezyum sülfatın yoğunluğu g/ml
Magnezyum sülfatın yoğunluğu bileşiğin durumuna bağlı olarak değişir. Susuz formun yoğunluğu 2,66 g/cm³, heptahidrat formunun yoğunluğu ise 1,68 g/cm³’tür. Yoğunluk, bir maddenin birim hacim başına kütle miktarını gösteren fiziksel bir özelliğidir. Magnezyum sülfatın yoğunluğu, kimyasal reaksiyon için gereken bir maddenin hacmini hesaplamak için kullanılabilir.
Magnezyum sülfatın moleküler ağırlığı
Magnezyum sülfatın moleküler ağırlığı 120.366 g/mol’dür. Bu değer, bir magnezyum atomu (24.305 g/mol), bir kükürt atomu (32.066 g/mol) ve dört oksijen atomunun (her biri 15.999 g/mol) atomik kütlelerinin eklenmesiyle hesaplanır. Molekül ağırlığı kimyasal hesaplamalarda önemli bir parametredir çünkü kimyasal reaksiyonda gerekli olan madde miktarının belirlenmesine yardımcı olur.
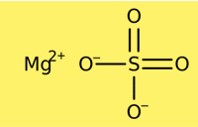
Magnezyum sülfatın yapısı
Magnezyum sülfat kristal bir yapıya sahiptir. Susuz form eşkenar dörtgen kristal yapıya sahipken, heptahidrat form monoklinik kristal yapıya sahiptir. Magnezyum sülfatın kristal yapısı magnezyum katyonlarından ve sülfat anyonlarından oluşur. Susuz form, hücre başına bir magnezyum katyonu ve bir sülfat anyonu içerirken, heptahidrat form, hücre başına bir magnezyum katyonu ve iki sülfat anyonu içerir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 2,66 (susuz) 1,68 (heptahidrat) |
| Renk | Renksizden beyaza |
| Koku | Kokusuz |
| Molar kütle | 120.366 gr/mol |
| Yoğunluk | 2,66 g/cm³ (susuz) 1,68 g/cm³ (heptahidrat) |
| Füzyon noktası | 1124°C (susuz) 150°C (heptahidrat) |
| Kaynama noktası | 1124°C (susuz) 150°C (heptahidrat) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 71,6g/100ml (20°C) |
| çözünürlük | Suda ve etanolde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| PKa | 9.99 |
| pH | 6,0 – 8,0 (%5 çözüm) |
Magnezyum sülfatın güvenliği ve tehlikeleri
Magnezyum sülfat, doğru şekilde kullanıldığında genellikle güvenli kabul edilir. Ancak dikkatli kullanılmadığı takdirde bazı tehlikelere yol açabilir. Magnezyum sülfat tozuna maruz kalmak gözleri, cildi ve solunum sistemini tahriş edebilir. Çok miktarda magnezyum sülfatın yutulması veya enjekte edilmesi ishal, mide krampları ve dehidrasyona neden olabilir. Magnezyum sülfatla çalışırken cildin ve gözlerin tahriş olmasını önlemek için eldiven ve gözlük gibi koruyucu ekipman kullanılması önemlidir. Yutulması veya maruz kalması durumunda derhal tıbbi yardıma başvurun. Magnezyum sülfat serin ve kuru bir yerde, ısı kaynaklarından ve uyumsuz malzemelerden uzakta saklanmalıdır.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | S22 – Tozu solumayın; S24/25 – Cilt ve gözlerle temasından kaçının; S36 – Uygun koruyucu kıyafet giyin; S26 – Gözle teması halinde derhal bol su ile yıkayın ve doktora başvurun; S45 – Kaza halinde veya kendinizi iyi hissetmiyorsanız derhal doktora başvurun (mümkünse doktora etiketi gösterin) |
| BİR tanımlayıcılar | UN3077 |
| HS kodu | 28332100 |
| Tehlike sınıfı | 9 |
| Paketleme grubu | III |
| Toksisite | LD50 (oral, sıçan) > 3.000 mg/kg; LD50 (deri, sıçan) > 2.000 mg/kg |
Magnezyum sülfat sentez yöntemleri
Magnezyum sülfatın (MgSO4) sentezlenmesi için farklı yöntemler mevcuttur.
Yaygın bir yöntem, magnezyum oksit veya magnezyum hidroksitin sülfürik asitle reaksiyona sokulmasıdır. İşlem, karışım tamamen eriyene kadar karıştırılarak sülfürik asite magnezyum oksit veya hidroksit eklenmesini içerir. Fazla suyu uzaklaştırmak için çözeltiyi buharlaştırarak MgSO4 magnezyum kristallerini toplayın.
Başka bir yaklaşım, tamamen eriyene kadar karıştırarak sülfürik asite yavaş yavaş magnezyum karbonat eklemektir. MgSO4 magnezyum kristalleri elde etmek için, elde edilen çözeltiyi filtreleyerek tüm safsızlıkları giderin ve buharlaştırın.
Magnezyumu sülfürik asitle reaksiyona sokun ve reaksiyon tamamlanana kadar karışımı ısıtın, ardından elde edilen çözeltiyi filtreleyin ve buharlaştırarak magnezyum MgS04 kristallerini elde edin.
Magnezyum klorürü sodyum MgSO4 ile reaksiyona sokarak da magnezyum MgSO4 elde edebilirsiniz. İşlem, bir sodyum MgS04 çözeltisine magnezyum klorürün eklenmesini, elde edilen karışımın karıştırılmasını ve magnezyum MgS04 kristalleri oluşana kadar ısıtılmasını içerir.
Magnezyum Sülfatın Kullanım Alanları
Magnezyum sülfatın (MgSO4) çeşitli alanlarda birçok uygulaması vardır. Kullanımlarından bazıları şunlardır:
- Tıbbi Kullanım Alanları: Hamilelik sırasında eklampsi ve preeklampsi tedavisinin yanı sıra şiddetli astım veya hipomagnezemili hastalarda nöbetleri önlemek için kullanılır. Rahatlatıcı ve müshil görevi görür.
- Tarım: Yüksek magnezyum ve kükürt içeriğinden dolayı gübre olarak kullanılır. Çiftçiler bunu topraktaki magnezyum eksikliklerini gidermek için kullanırlar.
- Yiyecek ve İçecek Endüstrisi: Bira üretiminde su kimyasını ayarlamak ve lezzeti iyileştirmek amacıyla bira tuzu olarak kullanılır. Gıda endüstrisi bunu tofu üretiminde pıhtılaştırıcı olarak kullanıyor.
- Endüstriyel uygulamalar: Kurutma maddesi ve kurutucunun yanı sıra alev geciktirici olarak da kullanılır. Çeşitli endüstriler bunu tekstil, kağıt ve kimyasal üretiminde kullanıyor.
- Kişisel bakım: İnsanlar kas ağrısını ve sertliğini azaltmak da dahil olmak üzere iddia edilen sağlık yararları için banyo tuzlarında ve ayak banyolarında magnezyum sülfat kullanırlar.
- Diğer kullanım alanları: Pigmentlerin, patlayıcıların üretiminde ve metallerin saflaştırılmasında kullanılır.
Sorular:
Soru: Diş macununda kullanılan baz nedir?
C: Diş macununda en sık kullanılan baz genellikle kalsiyum karbonat veya sodyum bikarbonattır. Bu bazlar dişlerin fırçalanmasına ve plakların çıkarılmasına yardımcı olur.
S: Magnezyum sülfat ne için kullanılır?
C: Magnezyum sülfatın, hamilelik sırasında eklampsi ve preeklampsinin tedavisi, rahatlatıcı ve müshil olarak, gübre olarak, bira tuzu olarak, yangın geciktirici olarak ve kurutma maddesi olarak da dahil olmak üzere çeşitli kullanımları vardır. Ayrıca tekstil, kağıt ve kimyasalların imalatında da kullanılır.
S: Magnezyum sülfat çözünür mü?
C: Magnezyum sülfat suda ve alkolde çözünür.
Soru: Magnezyum sülfat suda çözünür mü?
C: Evet, magnezyum sülfat suda yüksek oranda çözünür ve oda sıcaklığında yaklaşık 25,5 g/100 ml’lik bir çözünürlüğe sahiptir.
S: Magnezyum sülfat ne için kullanılır?
C: Magnezyum sülfatın spesifik uygulamaya bağlı olarak çeşitli kullanımları ve faydaları vardır. Kullanımlarından bazıları tıbbi tedavi, gübre, bira tuzu, yangın geciktirici ve kurutma maddesi olarak sayılabilir. Tıbbi olarak magnezyum sülfat, nöbetleri önlemek, kabızlığı tedavi etmek ve kas ağrısını ve sertliğini azaltmak için kullanılabilir.
