Magnezyum nitrat, Mg(NO3)2 kimyasal formülüne sahip beyaz kristalli bir bileşiktir. Yüksek reaktivite ve oksitleyici özelliklerinden dolayı gübre, patlayıcı ve piroteknik ürünlerin üretiminde kullanılır.
| IUPAC Adı | Magnezyum dinitrat |
| Moleküler formül | Mg(NO3)2 |
| CAS numarası | 10377-60-3 |
| Eş anlamlı | Nitrik asit, magnezyum tuzu; BM 1474; Magnezyum nitrat (II); Nitrik asidin magnezyum tuzu (2+) |
| InChI | InChI=1S/Mg.2NO3/c;22-1(3)4/q+2;2-1 |
Magnezyum Nitrat Formülü
Magnezyum nitratın kimyasal formülü Mg(NO3)2’dir; bu, bileşiğin bir magnezyum katyonu (Mg²⁺) ve iki nitrat anyonu (NO₃⁻) içerdiğini gösterir. Bu formül, bileşiğin stokiyometrisini kimyasal denklemlerde temsil etmek için kullanılır ve ayrıca magnezyum nitratın moleküler ağırlığını ve diğer özelliklerini belirlemek için kullanılır.
Magnezyum nitratın molar kütlesi
Mg(NO3)2 kimyasal formülüyle temsil edilen magnezyum nitratın molar kütlesi yaklaşık 148,31 g/mol’dür. Bu değer, bileşikte bulunan magnezyumun atomik kütleleri (24,31 g/mol), iki nitrojen atomu (her biri 28,02 g/mol) ve altı oksijen atomu (her biri 16,00 g/mol) eklenerek hesaplanabilir. Molar kütleyi bilmek, kimyasal reaksiyonlar veya çözeltilerin hazırlanması için gerekli olan magnezyum nitrat miktarının belirlenmesinde çok önemlidir.
Magnezyum nitratın kaynama noktası
Mg(NO3)2, atmosferik basınçta yaklaşık 330°C (626°F) gibi nispeten yüksek bir kaynama noktasına sahiptir. Bu değer bileşiğin saflığına ve konsantrasyonuna bağlı olarak biraz değişebilir. Mg(NO3)2’nin kaynama noktası gübre, patlayıcı ve piroteknik üretiminin yanı sıra laboratuvar deneylerini içeren endüstriyel işlemlerde önemlidir.
Magnezyum nitratın erime noktası
Katı bileşiğin sıvı duruma geçtiği sıcaklık olan Mg(NO3)2’nin erime noktası, susuz form için yaklaşık 89°C (192°F) ve susuz form için yaklaşık 95°C’dir (203° F). susuz form. hekzahidratlı form. Mg(NO3)2’nin hekzahidrat formu, stabilitesi ve kullanım kolaylığı nedeniyle daha yaygın olarak kullanılır. Erime noktası, çeşitli endüstriyel işlemlerde olduğu gibi Mg(NO3)2’nin saflığını belirlemek için kullanılan temel bir fiziksel özelliktir.
Magnezyum nitratın yoğunluğu g/ml
Mg(NO3)2’nin yoğunluğu bileşiğin formuna bağlı olarak değişir. Susuz formun yoğunluğu yaklaşık 2,3 g/cm³ iken heksahidrat formunun yoğunluğu yaklaşık 1,46 g/cm³’tür. Mg(NO3)2 yoğunluğu, kimyasal reaksiyonlarda gerekli olan bileşiğin hacminin belirlenmesinde, ayrıca depolanması ve taşınmasında çok önemli bir faktördür.
Magnezyum Nitratın Molekül Ağırlığı
Bileşikteki tüm elementlerin atom ağırlıklarının toplamı olan Mg(NO3)2’nin moleküler ağırlığı yaklaşık 148,31 g/mol’dür. Bu değer çeşitli kimyasal hesaplamalarda, özellikle reaksiyonlarda veya çözeltilerin hazırlanmasında gerekli olan Mg(NO3)2 miktarının belirlenmesinde önemlidir.
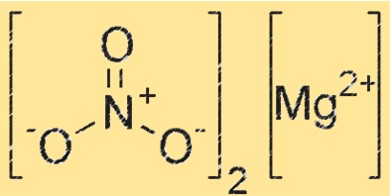
Magnezyum nitratın yapısı
Mg(NO3)2 ortorombik kristal sistemine ait bir kristal yapıya sahiptir. Bileşik, magnezyum katyonlarından (Mg²⁺) ve nitrat anyonlarından (NO₃⁻) oluşur; her bir magnezyum katyonu, oktahedral bir düzende altı nitrat anyonuyla çevrilidir. Mg(NO3)2’nin kristal yapısı, reaktivitesinde ve özelliklerinde çok önemli bir rol oynar.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 2,3 (susuz), 1,46 (heksahidrat) |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 148,31 gr/mol |
| Yoğunluk | 2,3 g/cm³ (susuz), 1,46 g/cm³ (hekzahidrat) |
| Füzyon noktası | 89°C (susuz), 95°C (heksahidrat) |
| Kaynama noktası | 330°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 234 g/L (susuz), 156 g/L (hekzahidrat) |
| çözünürlük | Suda, etanolde, metanolde çözünür |
| Buhar basıncı | 20°C’de 0,000009 mmHg |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 1.8 |
| pH | 4,5-6,0 (%5’lik çözüm) |
Magnezyum nitratın güvenliği ve tehlikeleri
Mg(NO3)2, uygun şekilde kullanılmazsa çeşitli güvenlik riskleri oluşturabilir. Temas veya solunması halinde ciltte, gözlerde ve solunum yollarında tahriş ve yanıklara neden olabilir. Bileşik aynı zamanda güçlü bir oksitleyici maddedir ve yanıcı ve yanıcı maddeler de dahil olmak üzere organik malzemelerle şiddetli reaksiyona girebilir. Mg(NO3)2 tozunun solunması solunum yolu tahrişine ve hatta akciğer hasarına neden olabilir. Mg(NO3)2’yi serin, kuru, iyi havalandırılmış bir alanda, tutuşma kaynaklarından uzakta saklayın ve kullanın. Bu bileşiği kullanırken eldiven ve koruyucu gözlük gibi uygun kişisel koruyucu ekipmanı kullanın.
| Tehlike sembolleri | Oksitleyici ajan |
| Güvenlik Açıklaması | Yanıcı malzemelerle temastan kaçının. Kişisel koruyucu ekipman giyin. Ateşleme kaynaklarından uzak tutun. |
| BİR tanımlayıcılar | BM 1474 |
| HS kodu | 283429 |
| Tehlike sınıfı | 5.1 (Oksitleyici maddeler) |
| Paketleme grubu | II |
| Toksisite | LD50 (oral, sıçan): 3.500 mg/kg; LD50 (kutanöz, tavşan): > 2000 mg/kg. Magnezyum nitrat kanserojen, mutajenik veya teratojenik olarak kabul edilmez. |
Magnezyum nitrat sentez yöntemleri
Magnezyum nitrat (Mg(NO3)2), magnezyum oksit veya magnezyum hidroksitin nitrik asitle reaksiyonu dahil olmak üzere çeşitli yöntemlerle sentezlenebilir.
Yöntemlerden biri, bir şişedeki nitrik asit çözeltisine magnezyum oksit eklenmesini ve ardından karışımın çözünene kadar hafifçe ısıtılmasını içerir. Mg(NO3)2 kristallerini elde etmek için, safsızlıkları gidermek üzere çözeltiyi filtreleyin ve çözücüyü buharlaştırın.
Başka bir sentez yöntemi, magnezyum metalinin nitrik asitle reaksiyona sokulmasını içerir. Asite magnezyum şeritleri ekleyin ve reaksiyonun tüm metal eriyene kadar devam etmesine izin verin. Daha sonra Mg(NO3)2 kristallerini elde etmek için elde edilen çözeltiyi buharlaştırın.
Mg(NO3)2 ve karbondioksiti oluşturmak için magnezyum karbonatı nitrik asitte çözün. Ortaya çıkan çözeltiyi süzün ve Mg(NO3)2 kristalleri elde etmek için buharlaştırın.
Diğer bir yöntem ise magnezyum hidroksitin nitrik asitle reaksiyona sokularak Mg(NO3)2 ve su üretilmesidir. Elde edilen çözelti daha sonra filtrasyon ve buharlaştırma yoluyla saflaştırılarak Mg(NO3)2 kristalleri elde edilir.
Magnezyum Nitratın Kullanım Alanları
Magnezyum nitratın çeşitli endüstrilerde ve uygulamalarda birçok kullanımı vardır. Mg(NO3)2’nin başlıca kullanım alanlarından bazıları şunlardır:
- Tarım: Özellikle domates, biber ve narenciye gibi yüksek düzeyde magnezyum gerektiren ürünlerde gübre olarak kullanılır. Bitki büyümesinin iyileştirilmesine yardımcı olur ve mahsul kalitesini ve verimini artırır.
- Piroteknik Ürünler: Parlak, yoğun alevler üretebildiği ve yanma oranının kontrol edilmesine yardımcı olabileceği için havai fişeklerde ve diğer piroteknik uygulamalarda oksitleyici olarak kullanılır.
- Cam Üretimi: Camın erime noktasını düşürmek ve akış özelliklerini iyileştirmek amacıyla cam üretiminde flux olarak kullanılır.
- Kimyasal sentez: Diğer magnezyum bileşiklerinin, katalizörlerin ve farmasötiklerin üretimi gibi çeşitli kimyasal sentez reaksiyonlarında reaktif olarak kullanılır.
- Koruma: Bakteri ve diğer mikroorganizmaların büyümesini engellemek için gıda koruyucu olarak kullanılır.
- Endüstriyel uygulamalar: Alev geciktirici olarak kullanılan magnezyum oksit ve magnezyum hidroksit üretiminde, atık su arıtımında ve asidik topraklarda nötrleştirici madde olarak kullanılır.
- Laboratuvar Araştırması: Standart çözeltilerin hazırlanması ve analitik prosedürlerin test edilmesi gibi çeşitli laboratuvar deneylerinde ve araştırmalarında kullanılır.
Sorular:
S: Mg(NO3)2 çözünür mü?
C: Evet, magnezyum nitrat suda çok çözünür.
S: Magnezyum nitratın formülü nedir?
C: Magnezyum nitratın formülü Mg(NO3)2’dir.
Soru: Mg(NO3)2’nin molar kütlesi nedir?
A: Mg(NO3)2’nin molar kütlesi 148,31 g/mol’dür.
Soru: Mg(NO3)2’nin formül ağırlığı nedir?
A: Mg(NO3)2’nin formül ağırlığı 148,31 g/mol’dür.
S: Mg(NO3)2’nin sistematik adı nedir?
C: Mg(NO3)2’nin sistematik adı magnezyum dinitrattır.
S: 0,125 M Mg(NO3)2 çözeltisindeki nitrat iyonlarının konsantrasyonu nedir?
A: 0,125 M Mg(NO3)2 çözeltisindeki nitrat iyonlarının konsantrasyonu 0,25 M’dir, çünkü her magnezyum iyonuna karşılık iki nitrat iyonu vardır.
Soru: Mg(NO3)2’nin formül kütlesi nedir?
A: Mg(NO3)2’nin formül kütlesi 148,31 g/mol’dür.
