Magnezyum karbonat (MgCO3), antiasit ve müshil olarak yaygın olarak kullanılan beyaz toz halinde bir maddedir. Ayrıca bazı kozmetiklerde ve diş macunlarında da bulunur. Magnezyum karbonat aşırı mide asidini nötralize etmeye ve kabızlığı gidermeye yardımcı olur.
| IUPAC’ın adı | Magnezyum karbonat |
| Moleküler formül | MgCO3 |
| CAS numarası | 546-93-0 |
| Eş anlamlı | Manyezit, Magnesia carbonica, magnezyum tuzu, (MgCO3) |
| InChI | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Magnezyum karbonatın özellikleri
Magnezyum Karbonat Formülü
Magnezyum karbonatın kimyasal formülü MgCO3’tür. Bu formül, magnezyum karbonatın bir Mg+2 iyonu ve bir CO3 2- iyonu içerdiğini gösterir. CO3 2-iyonu bir C atomu ve üç O atomundan oluşur. Magnezyum karbonatın kimyasal formülü önemli bir özelliktir çünkü magnezyum karbonatın ve onu oluşturan elementlerin bileşimini tanımlar.
Magnezyum Karbonat Molar Kütlesi
MgCO3’ün molar kütlesi 84,31 g/mol’dür. Bu değer, bir mol MgCO3’e magnezyum, karbon ve oksijen atomlarının atom kütlelerinin eklenmesiyle elde edilir. Molar kütle MgCO3’ün önemli bir fiziksel özelliğidir çünkü belirli bir numunedeki MgCO3’ün mol sayısının belirlenmesi gibi çeşitli hesaplamalarda kullanılır.
Magnezyum karbonatın kaynama noktası
MgCO3’ün belirli bir kaynama noktası yoktur çünkü kaynama noktasına ulaşmadan ayrışır. MgCO3 ısıtıldığında magnezyum oksit ve karbondioksite ayrışır. MgCO3’ün ayrışması yaklaşık 350°C sıcaklıkta gerçekleşir.
Magnezyum karbonat Erime noktası
MgCO3’ün erime noktası 990°C’dir. Bu sıcaklıkta MgCO3 erir ve bozunarak magnezyum oksit ve karbon dioksit oluşturur. MgCO3’ün erime noktası önemli bir fiziksel özelliktir çünkü MgCO3’ün eritilip işlenebileceği sıcaklığı belirler.
Magnezyum Karbonatın Yoğunluğu g/mL
MgCO3’ün yoğunluğu 2,958 g/mL’dir. Bu değer, bir mol MgCO3’ün kütlesinin hacmine bölünmesiyle elde edilir. MgCO3’ün yoğunluğu önemli bir fiziksel özelliktir çünkü belirli bir çözeltide MgCO3’ün kaldırma kuvvetinin belirlenmesi gibi çeşitli uygulamalarda kullanılır.
Magnezyum Karbonat Molekül Ağırlığı
MgCO3’ün moleküler ağırlığı 84,31 g/mol’dür. Bu değer, bir MgCO3 molekülündeki magnezyum, karbon ve oksijen atomlarının atomik kütlelerinin eklenmesiyle elde edilir. MgCO3’ün moleküler ağırlığı önemli bir fiziksel özelliktir çünkü belirli bir kimyasal reaksiyon için gerekli MgCO3 miktarının belirlenmesi gibi çeşitli hesaplamalarda kullanılır.
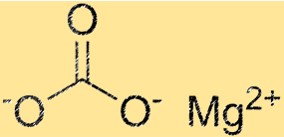
Magnezyum karbonatın yapısı
MgCO3 trigonal kristal yapıya sahiptir. Magnezyum iyonu yapının merkezinde bulunur ve altı karbonat iyonu ile çevrilidir. Karbonat iyonları, magnezyum iyonunun etrafında altıgen bir düzende düzenlenmiştir. MgCO3’ün kristal yapısı önemli bir özelliktir çünkü fiziksel ve kimyasal özelliklerini belirler.
| Dış görünüş | Beyaz katı |
| Spesifik yoğunluk | 2,958 gr/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 84,31 gr/mol |
| Yoğunluk | 2,958 gr/ml |
| Füzyon noktası | 990°C |
| Kaynama noktası | Kaynama noktasına ulaşmadan ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 0,02 g/L (15°C) |
| çözünürlük | Asitlerde çözünür, suda çözünmez |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 10.3 |
| pH | 9.2-10.2 |
Magnezyum karbonatın güvenliği ve tehlikeleri
MgCO3 güvenli bir bileşik olarak kabul edilir. Yanıcı, patlayıcı veya zehirli değildir. Ancak diğer kimyasal bileşikler gibi dikkatli kullanılmalıdır. MgCO3 tozunun solunması solunum yolu tahrişine neden olabilir. MgCO3 ile çalışırken eldiven ve koruyucu gözlük gibi uygun kişisel koruyucu ekipmanların kullanılması tavsiye edilir. MgCO3 serin ve kuru bir yerde, ısı ve tutuşma kaynaklarından uzakta saklanmalıdır. Dökülen MgCO3 derhal temizlenmeli ve uygun şekilde bertaraf edilmelidir. Potansiyel tehlikelerden kaçınmak için MgCO3’ü kullanırken uygun güvenlik önlemlerinin takip edilmesi önemlidir.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Tehlikeli olarak sınıflandırılmadı |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 2836.60.00 |
| Tehlike sınıfı | Tehlikeli olarak sınıflandırılmadı |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük toksisite, uygun şekilde kullanıldığında önemli bir sağlık riski olarak değerlendirilmez |
Magnezyum karbonat sentez yöntemleri
MgCO3’ü sentezlemek için çökeltme ve termal ayrışma dahil olmak üzere çeşitli yöntemler vardır.
Çökeltme yöntemini kullanarak MgCO3 oluşturmak için, çözünebilir bir karbonat ( sodyum karbonat veya magnezyum nitrat gibi) içeren bir çözeltiye, çözünür bir magnezyum tuzu ( magnezyum klorür veya magnezyum nitrat gibi) eklersiniz. amonyum karbonat). Daha sonra elde edilen karışımı karıştırın ve bekletin. Bu, MgCO3’ün çözeltiden çökelmesine neden olur. Bundan sonra çökeltiyi süzün, yıkayın ve kurutun.
Termal ayrıştırma yöntemiyle MgCO3 elde etmek için, magnezyum hidroksit veya magnezyum oksit, karbondioksit eklenirken ısıtılır. Bu reaksiyon MgCO3 ve su buharının oluşumuna yol açar. Bir sonraki adım MgCO3’ün toplanması, saflaştırılması ve kurutulmasıdır.
MgCO3’ü sentezlemenin başka bir yöntemi de magnezyum sülfat ve sodyum karbonatın reaksiyona sokulmasıdır. Su, iki bileşiği çözer ve daha sonra karıştırır ve MgCO3’ün çözeltiden çökelmesine neden olur. İşlem daha sonra çökeltiyi toplar, yıkar ve kurutur.
Magnezyum Karbonatın Kullanım Alanları
MgCO3 farklı endüstrilerde çeşitli kullanımları olan çok yönlü bir bileşiktir. İşte bazı kullanımları:
- Gıda takviyesi: Vücuda gerekli magnezyumu sağlama özelliğinden dolayı gıda takviyesi olarak kullanılır.
- Antasit: Mide ekşimesi ve hazımsızlığı tedavi etmek için antiasit olarak kullanılır.
- Endüstriyel Uygulamalar: Seramik, cam ve çimento üretimi gibi çeşitli endüstriyel uygulamalarda kullanılır.
- Kozmetik: Kozmetiklerde şişirici, emici ve opaklaştırıcı bir madde olarak kullanılır.
- Alev Geciktirici: Yalıtım malzemeleri, tekstil ve plastik dahil olmak üzere çeşitli uygulamalarda alev geciktirici olarak kullanılır.
- İlaçlar: Laksatifler ve antiasitler gibi çeşitli farmasötik ürünlerin üretiminde kullanılır.
- Gıda endüstrisi: Gıda ürünlerinin asitliğini düzenlemek amacıyla gıda katkı maddesi olarak ve topaklanmayı önleyici madde olarak kullanılır.
- Spor malzemeleri: Spor salonu tebeşiri gibi spor ekipmanlarında kavramayı iyileştirmek ve kaymayı önlemek için kullanılır.
Sorular:
Soru: Magnezyum karbonat suda çözünür mü?
C: MgCO3’ün suda çözünürlüğü düşüktür. Oda sıcaklığında 100 ml suda yalnızca 0,02 gram MgCO3 çözünebilir.
S: MgCO3 çözünür mü?
C: MgCO3’ün suda çözünürlüğü düşüktür, yani pek çözünmez.
S: Asetik asit ve MgCO3 reaksiyona girdiğinde ne oluşur?
C: Asetik asit ve MgCO3 reaksiyona girdiğinde magnezyum asetat, su ve karbondioksit oluştururlar. Bu reaksiyonun dengeli kimyasal denklemi MgCO3 + 2CH3COOH → Mg(CH3COO)2 + H2O + CO2’dir.
Soru: MgCO3’ün molar çözünürlüğü 1,8 × 10–4 mol/L’dir. Bu bileşik için Ksp nedir?
A: Molar çözünürlük kullanılarak MgCO3 için Ksp değeri:
Ksp = [Mg2+][CO32-], burada [Mg2+] molar çözünürlüğe eşittir ve [CO32-] de molar çözünürlüğe eşittir. Bu nedenle Ksp = (1,8 × 10–4 mol/L)2 = 3,24 × 10–9.
Soru: Aşağıdakilerden hangisi MgCO3’ün ayrışması sırasında oluşan üründür?
C: MgCO3 ayrıştığında magnezyum oksit (MgO) ve karbondioksit (CO2) oluşturur.
S: MgCO3(ler)in ΔH°f değerini hesaplamak için kullanılan reaksiyonun dengeli kimyasal denklemi nedir?
A: MgCO3(ler)’in standart oluşum entalpisini (ΔH°f) hesaplamak için kullanılan reaksiyonun dengeli kimyasal denklemi şöyledir: Mg(s) + CO2(g) → MgCO3(s).
