Magnezyum hipoklorit (Mg(ClO)2), magnezyum, oksijen ve klordan oluşan kimyasal bir bileşiktir. Dezenfektan, ağartıcı ve su arıtma kimyasalı olarak kullanılır.
| IUPAC’ın adı | Magnezyum hipoklorit |
| Moleküler formül | Mg(ClO)2 |
| CAS numarası | 10233-03-1 |
| Eş anlamlı | Magnezyum klorat, hipokloröz asidin magnezyum tuzu, magnezyum oksiklorür, MagOCl |
| InChI | InChI=1S/Cl2O2.Mg/c1-3-2;/q-1;+2 |
Magnezyum hipokloritin özellikleri
Magnezyum Hipoklorit Formülü
Magnezyum hipokloritin kimyasal formülü Mg(ClO)2’dir; bu, molekül başına bir magnezyum atomu, iki klor atomu ve iki oksijen atomu içerdiği anlamına gelir. Hafif klor kokusuna sahip beyaz bir katıdır ve yaygın olarak dezenfektan ve su arıtma kimyasalları olarak kullanılır.
Magnezyum Hipoklorit Molar Kütlesi
Mg(ClO)2’nin molar kütlesi 127,21 g/mol’dür. Bu değer, kimyasal formüldeki her bir elementin atomik kütleleri, yani magnezyum (24,31 g/mol), klor (35,45 g/mol) ve oksijen (15,99 g/mol) eklenerek hesaplanır. mol), ilgili endekslerle çarpılır.
Magnezyum hipokloritin kaynama noktası
Mg(ClO)2’nin tanımlanmış bir kaynama noktası yoktur çünkü kaynama noktasına ulaşmadan ayrışır. Mg(ClO)2 ısıtıldığında oksijen gazı açığa çıkarır ve geride katı bir kalıntı olarak magnezyum klorür bırakır.
Magnezyum hipoklorit Erime noktası
Mg(ClO)2’nin erime noktası 100°C’dir. Bu sıcaklıkta katı Mg(ClO)2 kristalleri sıvıya dönüşür. Ancak yüksek sıcaklıklarda kararsızlığı nedeniyle dikkatli kullanılması tavsiye edilir.
Magnezyum hipokloritin yoğunluğu g/mL
Mg(ClO)2’nin yoğunluğu oda sıcaklığında 2,08 g/mL’dir. Bu, bir mililitre Mg(ClO)2’nin kütlesinin 2,08 gram olduğu anlamına gelir.
Magnezyum Hipoklorit Molekül Ağırlığı
Mg(ClO)2’nin moleküler ağırlığı 127,21 g/mol’dür. Bileşikteki tüm elementlerin, yani magnezyum, klor ve oksijenin atom ağırlıklarının toplamıdır.
Magnezyum hipokloritin yapısı
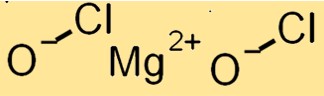
Mg(ClO)2 monoklinik kristal sistemine sahip bir kristal yapıya sahiptir. İyonik bağlarla bir arada tutulan Mg+2 katyonları ve ClO-anyonlardan oluşur. ClO-anyonları, Mg+2 katyonlarının etrafında çarpık bir tetrahedral düzendedir.
Magnezyum hipokloritin çözünürlüğü
Mg(ClO)2 suda az çözünür ve 20°C’de 14,6 g/100 mL’lik bir çözünürlüğe sahiptir. Hipoklorit iyonlarının hidrolizi nedeniyle suda hafif bazik bir çözelti oluşturur. Ancak Mg(ClO)2’nin suda çözünmesi zehirli ve insan sağlığına zararlı olabilecek klor gazı üretebileceğinden önerilmez.
| Dış görünüş | Beyaz katı |
| Spesifik yer çekimi | 20°C’de 2,08 g/mL |
| Renk | Beyaz |
| Koku | Hafif klorlu |
| Molar kütle | 127,21 gr/mol |
| Yoğunluk | 20°C’de 2,08 g/mL |
| Füzyon noktası | 100°C |
| Kaynama noktası | Kaynama noktasına ulaşmadan ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Az çözünür (20°C’de 14,6 g/100 mL) |
| çözünürlük | Suda az çözünür, asitlerde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Biraz temel çözüm |
Magnezyum Hipokloritin Güvenliği ve Tehlikeleri
Mg(ClO)2 doğru şekilde kullanılmazsa tehlikeli olabilir. Bazı kimyasallarla şiddetli reaksiyona girebilen güçlü bir oksitleyici maddedir. Cilt, göz ve mukoza ile teması tahrişe ve yanıklara neden olabilir. Toz veya sisin solunması solunum sorunlarına neden olabilir. Mg(ClO)2’nin asitler veya diğer klor içeren bileşiklerle karıştırılmasından kaçınmak da önemlidir çünkü bu, toksik klor gazı üretebilir. Mg(ClO)2 ile çalışırken eldiven ve gözlük gibi koruyucu ekipmanların kullanılması ve uyumsuz kimyasallardan uzak, serin ve kuru bir yerde saklanması tavsiye edilir.
| Tehlike sembolleri | Oksitleyici madde, zararlı |
| Güvenlik Açıklaması | Isıdan, kıvılcımlardan ve açık alevden uzak tutun. Tozu veya buğuyu solumayın. Eldiven ve koruyucu gözlük takın. |
| BM kimlik numaraları | 1748 |
| HS kodu | 2828.10.10 |
| Tehlike sınıfı | 5.1 (Yükseltgen madde), 6.1 (Zehirli) |
| Paketleme grubu | II |
| Toksisite | LD50 (oral, sıçan) – 290 mg/kg; LC50 (soluma, sıçan) – 2,07 mg/L/4 sa; Cilt tahrişi – Hafif; Göz tahrişi – Şiddetli |
Magnezyum hipoklorit sentez yöntemleri
Mg(ClO)2’yi sentezlemek için en yaygın kullanılan yöntem, magnezyum oksidin klor gazı ile reaksiyona sokulmasıdır.
Bir yöntemde Mg(ClO)2 üretmek için magnezyum oksidin su varlığında klor gazı ile karıştırılması gerekir. İstenmeyen yan ürünlerin oluşumunu önlemek için ekzotermik reaksiyon sırasında dikkatli kontrol gereklidir.
Başka bir yöntem, magnezyum hidroksit ile hipokloröz asit arasındaki reaksiyonu içerir. PH’ı korumak için reaksiyon genellikle bir sodyum hidroksit çözeltisi içinde gerçekleşir. Elde edilen Mg(ClO)2 solüsyonu süzülerek ayrılabilir ve reaksiyondan sonra kurutulabilir.
Üçüncü bir yöntem, magnezyum karbonat ile hipokloröz asit arasındaki reaksiyonu içerir. Bu reaksiyon Mg(ClO)2 ve karbondioksit üretir. İstenmeyen yan ürünlerin oluşumunu önlemek için reaksiyonun dikkatle izlenmesi gerekir.
Kullanılan sentez yöntemi ne olursa olsun, Mg(ClO)2’nin oksitleyici özellikleri ve potansiyel tehlikeleri nedeniyle dikkatli kullanılması önemlidir.
Magnezyum Hipokloritin Kullanım Alanları
Mg(ClO)2, oksitleyici özellikleri ve klor gazı salma yeteneği nedeniyle birçok pratik uygulamaya sahiptir. Mg(ClO)2’nin bazı yaygın kullanımları şunlardır:
- Su Arıtma: Su arıtma tesislerinde zararlı bakteri ve virüsleri öldürmek için yaygın olarak dezenfektan olarak kullanılır.
- Ağartıcı: Tekstil, kağıt ve diğer malzemeler için ağartma maddesi olarak kullanılır.
- Yüzme Havuzları: İyi su kimyasını korumak için yüzme havuzlarında sanitasyon maddesi olarak kullanılır.
- Koku Kontrolü: Atık arıtma tesislerinde ve kanalizasyon sistemlerinde hoş olmayan kokuları kontrol etmek için kullanılır.
- Oksitleyici madde: Epoksitler ve ketonlar gibi çeşitli kimyasalların üretiminde oksitleyici madde olarak kullanılır.
- Tarım: Tarımda mantar ve bakteri hastalıklarıyla mücadelede dezenfektan ve böcek ilacı olarak kullanılır.
- Sanitasyon: Hastaneler, gıda işleme tesisleri ve diğer tesislerdeki yüzeyler ve ekipmanlar için dezenfektan olarak da kullanılır.
Sorular:
S: Magnezyum hipokloritin formülü nedir?
C: Magnezyum hipokloritin formülü Mg(ClO)2’dir.
S: Magnezyum hipokloritin pH seviyesi nedir?
C: Mg(ClO)2’nin pH seviyesi konsantrasyonuna bağlıdır ve değişebilir. Bununla birlikte, bir Mg(ClO)2 çözeltisinin pH’ı genellikle 8 ila 10 arasındadır.
S: Magnezyum hipokloritin moleküler formülü nedir?
C: Magnezyum hipokloritin moleküler formülü Mg(ClO)2’dir.
Soru: Mg(ClO)2’nin adı nedir?
C: Mg(ClO)2’nin adı magnezyum hipoklorittir.
Soru: Mg(ClO)2 asit mi yoksa baz mı?
C: Mg(ClO)2 bazik bir tuzdur ve sulu çözeltilerde zayıf baz görevi görebilir.
Soru: Mg(ClO)2 bir tuz mudur?
C: Evet, Mg(ClO)2 tuzdur. Suda oldukça çözünür olan ve hem metal (magnezyum) hem de metal olmayan (klor) içeren beyaz kristalli bir bileşiktir.
