Magnezyum hidroksit (Mg(OH)2), mide yanması, hazımsızlık ve kabızlığı tedavi etmek için kullanılan bir antiasit ve müshildir. Mide asidini nötralize ederek ve bağırsak hareketlerini teşvik etmek için kolona su çekerek çalışır.
| IUPAC Adı | Magnezyum hidroksit |
| Moleküler formül | Mg(OH)2 |
| CAS numarası | 1309-42-8 |
| Eş anlamlı | Magnesianın sütü; Brusit; Magnezyum dihidroksit; Hidromanyezit; Beyaz Magnezya |
| InChI | InChI=1S/2H2O.Mg/h2*1H2;/q;;+2/p-2 |
Magnezyum hidroksitin özellikleri
Magnezyum Hidroksit Formülü
Magnezyum hidroksitin kimyasal formülü Mg(OH)2’dir. Bu formül, bir magnezyum atomunun iki hidroksit iyonuna bağlandığını gösterir. Magnezyum hidroksit formülü, maddenin molar kütlesini, yoğunluğunu ve diğer fiziksel özelliklerini hesaplamak için kullanılır. Formül aynı zamanda bir magnezyum hidroksit molekülünde bulunan atomların sayısını ve türlerini gösterdiğinden maddenin yapısına ilişkin fikir de sağlar.
Magnezyum Hidroksit Molar Kütlesi
Mg(OH)2’nin molar kütlesi 58,32 g/mol’dür. Bu, bir mol Mg atomu ve iki mol OH- iyonu içeren bir mol Mg(OH)2’nin kütlesidir. Molar kütle kimyada önemli bir kavramdır çünkü belirli bir numunedeki madde miktarını hesaplamak için kullanılır.
Magnezyum hidroksitin kaynama noktası
Mg(OH)2 kaynama noktasına ulaşmadan ayrıştığı için belirgin bir kaynama noktasına sahip değildir. Mg(OH)2’nin bozunma sıcaklığı yaklaşık 350°C’dir. Isıtıldığında Mg(OH)2 ayrışarak magnezyum oksit ve su oluşturur.
Magnezyum hidroksitin erime noktası
Mg(OH)2’nin erime noktası 350°C’dir. Bu sıcaklıkta katı Mg(OH)2 sıvı duruma geçer. Bu işleme birleştirme adı verilmektedir. Erime noktası bir maddenin önemli bir fiziksel özelliğidir çünkü katının sıvıya dönüştüğü sıcaklığı belirler.
Magnezyum hidroksitin yoğunluğu g/mL
Mg(OH)2’nin yoğunluğu yaklaşık 2,36 g/mL’dir. Yoğunluk, bir maddenin birim hacim başına kütlesi olarak tanımlanır. Mg(OH)2, yüksek molar kütlesi ve Mg atomu başına iki OH- iyonunun varlığı nedeniyle nispeten yoğun bir maddedir.
Magnezyum Hidroksit Molekül Ağırlığı
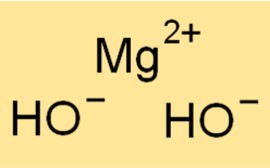
Mg(OH)2’nin moleküler ağırlığı 58,32 g/mol’dür. Bir Mg(OH)2 molekülündeki tüm atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı kimyada yararlı bir kavramdır çünkü belirli bir numunedeki bir maddenin miktarını belirlemek için kullanılır.
Magnezyum hidroksitin yapısı
Mg(OH)2, Mg2+ iyonları ve OH- iyonlarından oluşan katmanlı bir yapıya sahiptir. Mg2+ iyonları altı OH- iyonuyla çevrelenmiştir ve OH- iyonları sıkı paketlenmiş altıgen bir yapıda düzenlenmiştir. Mg(OH)2’nin katmanlı yapısı, sudaki düşük çözünürlüğü ve suda süspansiyon oluşturabilme yeteneği gibi karakteristik özelliklerine yol açmaktadır.
| Dış görünüş | Beyaz toz veya süspansiyon |
| Spesifik yer çekimi | 2.36g/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 58,32 gr/mol |
| Yoğunluk | 2.36g/ml |
| Füzyon noktası | 350°C |
| Kaynama noktası | 350°C’de ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 12 mg/L |
| çözünürlük | Etanol ve eterde çözünmez |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 10.4 |
| pH | 10.5 |
Magnezyum Hidroksitin Güvenliği ve Tehlikeleri
Mg(OH)2’nin genellikle işlenmesi ve kullanılması güvenli olduğu, düşük toksisiteye sahip olduğu ve bilinen hiçbir kanserojen etkisi olmadığı kabul edilir. Ancak Mg(OH)2 tozuna veya tozuna uzun süre maruz kalmak solunum yolu tahrişine ve akciğer hasarına neden olabilir. Mg(OH)2 ayrıca temas halinde gözlerde, ciltte ve mukoza zarlarında tahrişe veya korozyona neden olabilir. Mg(OH)2 ile çalışırken koruyucu ekipman giymek ve iyi havalandırılmış bir alanda çalışmak gibi uygun güvenlik önlemlerinin takip edilmesi önemlidir. Temas veya maruz kalma durumunda tıbbi yardım alın ve etkilenen bölgeleri suyla iyice durulayın.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | – Teneffüs etmekten ve göz, cilt ve giysilerle temasından kaçının. – Koruyucu kıyafet, eldiven ve göz/yüz koruması kullanın. – İyi havalandırılan bir ortamda kullanınız. |
| BM kimlik numaraları | Düzenlenmemiş |
| HS kodu | 2826.90.90 |
| Tehlike sınıfı | sınıflandırılmamış |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük toksisite; uzun süreli maruz kalma solunum yolu tahrişine ve akciğer hasarına neden olabilir. |
Magnezyum hidroksit sentez yöntemleri
Çökeltme, hidrotermal sentez ve elektrokimyasal biriktirme gibi çeşitli yöntemler Mg(OH)2’yi sentezleyebilir.
Çökeltme yöntemi, Mg(OH)2 oluşturmak üzere sodyum hidroksitin veya amonyum hidroksitin magnezyum klorür veya magnezyum sülfatla reaksiyona sokulmasını içerir. Reaksiyon, daha sonra birisinin toplayıp kurutabileceği Mg(OH)2’yi üretir.
Hidrotermal sentez gerçekleştirmek için, magnezyum oksit veya magnezyum karbonat eklenirken suyun yüksek basınç ve sıcaklığa ısıtılması gerekir. İşlem Mg(OH)2 üretecektir ve elde edilen çözeltiyi soğutarak kristalleri toplayabilirsiniz.
Elektrokimyasal biriktirme, bir magnezyum iyonları çözeltisinden bir elektrik akımının geçirilmesini, bunların hidroksit iyonlarıyla reaksiyona girmesine ve katotta Mg(OH)2 oluşturmasına neden olmasını içerir.
Mg(OH)2’yi sentezlemenin diğer yöntemleri arasında magnezyum oksit ve kireç sütünün kullanımı ve magnezyum bikarbonatın termal ayrışması yer alır.
Her yöntemin etkinlik, verimlilik ve maliyet açısından avantaj ve dezavantajları vardır. Sentez yönteminin seçimi spesifik uygulamaya ve Mg(OH)2 ürününün istenen özelliklerine bağlıdır.
Magnezyum Hidroksit Kullanım Alanları
Mg(OH)2’nin çeşitli endüstrilerde geniş bir uygulama yelpazesi vardır:
- Antiasit: Genellikle mide asidini nötralize etmek ve mide yanmasını, hazımsızlığı ve diğer sindirim rahatsızlıklarını gidermek için antiasit olarak kullanılır.
- Alev Geciktirici: Plastik, kauçuk ve tekstilde yangın riskini azaltmak için kullanılan, toksik olmayan bir alev geciktiricidir.
- pH Ayarı: Su arıtma solüsyonları, kozmetikler ve farmasötikler de dahil olmak üzere çeşitli ürünlerin pH’ını ayarlamak için kullanılır.
- Çevresel İyileştirme: Asidik koşulları nötralize etmek ve ağır metalleri uzaklaştırmak için atık su ve asit maden drenajının arıtılmasında kullanılır.
- Gübre: Bitkilere magnezyum sağlamak ve toprak pH’ını iyileştirmek için gübre olarak kullanılır.
- Tıbbi Uygulamalar: Müshil olarak ve kolonoskopi gibi bazı tıbbi prosedürlerde bağırsağı temizlemek için kullanılır.
- Diğer Uygulamalar: Lateks boyada stabilizatör, kağıtta beyazlatıcı, cam ve seramikte parlatıcı olarak kullanılır.
Sorular:
Soru: Diş macununda kullanılan baz nedir?
C: Mg(OH)2, ağızdaki asidik koşulları nötralize etmeye ve diş çürümesi riskini azaltmaya yardımcı olmak için diş macunlarında yaygın olarak baz olarak kullanılır.
S: Magnezyum hidroksitin formülü nedir?
A: Magnezyum hidroksitin kimyasal formülü Mg(OH)2’dir.
S: Magnezyum hidroksitin ayrışmasını hangi kimyasal denklem gösterir?
A: Mg(OH)2’nin ayrışmasının kimyasal denklemi:
Mg(OH)2 → Mg2+ + 2OH-.
S: Magnezyum hidroksit suda çözünür mü?
C: Mg(OH)2 suda çok az çözünür, yani çok sınırlı ölçüde çözünür.
Soru: Aşağıdaki maddelerden hangisi Arrhenius asididir? BF3, HCN, NH3, Mg(OH)2?
C: Listelenen maddelerin hiçbiri Arrhenius asitleri değildir. BF3 ve HCN Lewis asitleridir, NH3 zayıf bir Arrhenius bazıdır ve Mg(OH)2 güçlü bir Arrhenius bazıdır.
S: Mg(OH)2 suda çözünür mü?
C: Mg(OH)2 suda çok az çözünür, yani çok sınırlı ölçüde çözünür.
Soru: Mg(OH)2’nin molar kütlesi nedir?
A: Mg(OH)2’nin molar kütlesi yaklaşık 58,32 g/mol’dür.
Soru: Mg(OH)2 asit mi yoksa baz mı?
C: Mg(OH)2 bir bazdır çünkü hidrojen iyonlarını (protonları) kabul ederek su ve tuz oluşturabilir.
