Magnezyum fosfat (Mg3(PO4)2), magnezyum ve fosfat iyonlarından oluşan bir bileşiktir. DNA sentezi, sinir fonksiyonu ve kas kasılması gibi birçok biyolojik süreçte hayati bir rol oynar.
| IUPAC Adı | Magnezyum Fosfat |
| Moleküler formül | Mg3(PO4)2 |
| CAS numarası | 7757-87-1 |
| Eş anlamlı | Trimagnezyum fosfat, trimagnezyum ortofosfat, magnezyum ortofosfat, tersiyer magnezyum fosfat, tribazik magnezyum fosfat |
| InChI | InChI=1S/2Mg.3H3O4P/c;;3 1-5(2,3)4/h;;3 (H3,1,2,3,4)/q2*+2;;;/p-6 |
Magnezyum fosfatın özellikleri
Magnezyum Fosfat Formülü
Magnezyum fosfatın kimyasal formülü Mg3(PO4)2’dir, bu da onun üç Mg+2 iyonu ve iki PO43- iyonu içerdiğini gösterir. Formül stokiyometrik hesaplamalar için önemlidir ve Mg3(PO4)2 içeren kimyasal reaksiyonlarda doğru miktarda reaktan ve ürünün belirlenmesine yardımcı olur.
Magnezyum Fosfat Molar Kütlesi
Mg3(PO4)2’nin molar kütlesi 262,86 g/mol’dür. Bu değer, üç Mg+2 iyonu ve iki PO4- iyonunun birleşimi olan Mg3(PO4)2 bileşiğinin bir molünün kütlesini temsil eder. Molar kütle, çeşitli kimyasal reaksiyonlarda ihtiyaç duyulan Mg3(PO4)2 miktarını belirlemek için stokiyometrik hesaplamalarda kullanılan çok önemli bir özelliktir.
Magnezyum fosfatın kaynama noktası
Mg3(PO4)2 kaynama noktasına ulaşmadan ayrıştığı için tanımlanmış bir kaynama noktasına sahip değildir. Yüksek sıcaklıklarda, Mg3(PO4)2 sırasıyla 3.600°C ve 300°C kaynama noktalarına sahip magnezyum oksit ve fosfor pentoksite ayrışır. Mg3(PO4)2’nin bozunma sıcaklığı konsantrasyon, ısıtma hızı ve basınç gibi çeşitli faktörlere bağlıdır.
Magnezyum Fosfatın Erime Noktası
Mg3(PO4)2’nin erime noktası 1188°C’dir. Bu sıcaklıkta bileşik katı halden sıvı duruma faz değişimine uğrar. Mg3(PO4)2’nin erime noktası basınç, safsızlıklar ve kristal yapı gibi çeşitli faktörlerden etkilenir.
Magnezyum fosfatın yoğunluğu g/mL
Mg3(PO4)2’nin yoğunluğu kristal yapısına ve ölçüldüğü koşullara bağlı olarak değişir. Mg3(PO4)2’nin en yaygın biçimi olan tri-Mg3(PO4)2’nin yoğunluğu 2,195 g/mL’dir. Yoğunluk değeri, çeşitli uygulamalarda belirli bir hacme ulaşmak için gereken Mg3(PO4)2 kütlesinin belirlenmesi için gereklidir.
Magnezyum Fosfat Molekül Ağırlığı
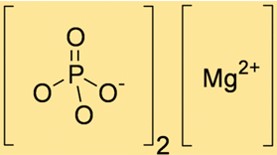
Mg3(PO4)2’nin molekül ağırlığı 262,86 g/mol’dür. Bu değer, bileşikte bulunan Mg ve PO43- iyonlarının atom ağırlıkları toplanarak hesaplanır. Mg3(PO4)2’nin moleküler ağırlığı, çeşitli kimyasal reaksiyonlarda ihtiyaç duyulan Mg3(PO4)2 miktarının belirlenmesinde faydalıdır.
Magnezyum fosfatın yapısı
Mg3(PO4)2, hazırlama yöntemine ve koşullarına bağlı olarak değişen bir kristal yapıya sahiptir. En yaygın biçim, altıgen bir kafes halinde düzenlenmiş Mg+2 iyonları ve PO43- iyonlarından oluşan bir kristal yapıya sahip olan tri-Mg3(PO4)2’dir. Kristal yapısı Mg3(PO4)2’nin fiziksel ve kimyasal özelliklerini etkiler.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yer çekimi | 2.195 |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 262,86 gr/mol |
| Yoğunluk | 2,195 gr/ml |
| Füzyon noktası | 1188°C |
| Kaynama noktası | Kaynama noktasından önce ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünmez |
| çözünürlük | Asitlerde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 7.2 |
| pH | 8-9 (%10’luk çözüm) |
Magnezyum fosfatın güvenliği ve tehlikeleri
Mg3(PO4)2 genellikle güvenli ve toksik olmadığı kabul edilir. Tehlikeli madde olarak sınıflandırılmaz ve insan sağlığına veya çevreye önemli riskler teşkil etmez. Ancak yüksek konsantrasyonlu Mg3(PO4)2 tozuna uzun süre maruz kalmak solunum yolu tahrişine neden olabilir. Büyük miktarlarda Mg3(PO4)2’nin yutulması mide-bağırsak tahrişine ve mide bulantısına neden olabilir. Mg3(PO4)2’yi dikkatli bir şekilde kullanmak ve büyük miktarlarda bileşikle çalışırken uygun kişisel koruyucu ekipman giymek önemlidir. Kayma veya düşme riskini önlemek için herhangi bir dökülme veya sızıntı derhal temizlenmelidir.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Tehlikeli olarak sınıflandırılmadı |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 2835.29.10 |
| Tehlike sınıfı | sınıflandırılmamış |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Normal konsantrasyonlarda toksik değildir |
Magnezyum fosfat sentez yöntemleri
Mg3(PO4)2’yi çökeltme, magnezyum oksidin fosforik asitle reaksiyonu ve magnezyum hidroksitin fosforik asitle reaksiyonu dahil olmak üzere çeşitli yöntemler sentezleyebilir.
Çökeltme işlemi, MgCl2 veya magnezyum sülfat gibi çözünür bir Mg+2 tuzu içeren bir çözeltiye Na3PO4 gibi çözünür bir fosfat tuzunun eklenmesini içerir. Daha sonra iki çözeltinin karıştırılması, toplanıp kurutulabilen bir Mg3(PO4)2 çökeltisi üretir.
Reaksiyon, bir fosforik asit çözeltisine magnezyum oksidin eklenmesini ve reaksiyonun tamamlanması için karışımın ısıtılmasını içerir. İşlem daha sonra ortaya çıkan Mg3(PO4)2’yi toplayıp yıkayarak her türlü yabancı maddeyi uzaklaştırır.
Reaksiyon, bir fosforik asit çözeltisine magnezyum hidroksitin eklenmesini ve karışımın tamamlanması için ısıtılmasını içerir. Daha sonra elde edilen Mg3(PO4)2’yi toplayın ve tüm yabancı maddeleri çıkarmak için iyice yıkayın.
Hammaddelerin kalitesine ve reaksiyon koşullarına bağlı olarak bu yöntemler, değişen saflık derecelerinde Mg3(PO4)2 üretmek için kullanılabilir.
Magnezyum Fosfatın Kullanım Alanları
Mg3(PO4)2’nin çeşitli endüstrilerde çeşitli kullanımları vardır:
- Gıda Endüstrisi: Asitlik seviyelerini düzenlemek ve unlu mamullerin, süt ürünlerinin ve içeceklerin dokusunu ve kalitesini iyileştirmek için gıda katkı maddesi olarak kullanılır.
- Tarım: Bitkilere magnezyum ve fosfor gibi temel besinleri sağlamak için gübre olarak kullanılır.
- İlaç Endüstrisi: Hazımsızlık ve kabızlık semptomlarını hafifletmeye yardımcı olmak için antasitler ve müshillerde aktif madde olarak kullanılır.
- Su Arıtma: Kazanlarda ve borularda kireç oluşumunu kontrol etmek ve korozyonu önlemek amacıyla su arıtma kimyasalı olarak kullanılır.
- Seramik endüstrisi: Seramik ürünlerin mukavemetini ve dayanıklılığını arttırmak için seramik bağlayıcı olarak kullanılır.
- Yangın Geciktirici: Yalıtım, alçıpan ve dış cephe kaplama gibi yapı malzemelerinde alev geciktirici olarak kullanılır.
- Kozmetik: Kozmetik ve kişisel bakım ürünlerinde koyulaştırıcı ve emülgatör olarak kullanılır.
Sorular:
Soru: Mg+2 ve PO43- iyonları arasında oluşan bileşiğin doğru formülü nedir?
C: Mg+2 iyonları ile PO43- iyonları arasında oluşan bileşiğin doğru formülü Mg3(PO4)2’dir.
S: Magnezyum fosfatın formülü nedir?
A: Magnezyum fosfatın formülü Mg3(PO4)2’dir.
S: Magnezyum fosfatın bir formül birimini kaç iyon oluşturur?
C: Bir Mg3(PO4)2 formül birimi 11 iyon içerir: üç Mg+2 iyonu ve iki PO43- iyonu.
S: Magnezyum fosfat çözünür mü?
C: Mg3(PO4)2’nin suda çözünürlüğü düşük olup, oda sıcaklığında çözünürlüğü yaklaşık 0,1 g/100 mL’dir.
Soru: Bir asit (x), bir baz (y) ile reaksiyona girerek Mg3(PO4)2 üretiyor. x ve y nedir?
A: Asit (x) fosforik asittir (H3PO4) ve baz (y) magnezyum hidroksittir (Mg(OH)2).
S: Eskiden tıbbi olarak antiasit olarak kullanılan bir madde olan Mg3(PO4)2’nin molar kütlesi nedir?
A: Mg3(PO4)2’nin molar kütlesi 262,86 g/mol’dür.
S: Mg3(PO4)2 suda çözünür mü?
C: Mg3(PO4)2’nin suda çözünürlüğü düşük olup, oda sıcaklığında çözünürlüğü yaklaşık 0,1 g/100 mL’dir.
Soru: Bir mol Mg3(PO4)2’de kaç mol oksijen atomu vardır?
Cevap: Bir mol Mg3(PO4)2 8 mol oksijen atomu içerir.
