Magnezyum bromür (MgBr2), Mg ve Br’den oluşan bir bileşiktir. Organik sentez reaksiyonlarında katalizör olarak ve tıpta sakinleştirici olarak yaygın olarak kullanılır.
| IUPAC Adı | Magnezyum bromür |
| Moleküler formül | MgBr2 |
| CAS numarası | 7789-48-2 |
| Eş anlamlı | Magnezyum dibromid, UN1913, Bromomanyezit, Magnezyum bromatum, Magnezyumbromid, Magnezyum bromür |
| InChI | InChI=1S/2BrH.Mg/h2*1H;/q;;+2/p-2 |
Magnezyum bromürün özellikleri
Magnezyum Bromür Formülü
Magnezyum bromürün kimyasal formülü MgBr2’dir. Bu MgBr2’nin bir Mg+2 iyonu ve iki Br- iyonundan oluştuğunu gösterir. Formül, bir moleküldeki atomların oranını temsil eder ve bir bileşiğin özelliklerinin belirlenmesinde hayati bir rol oynar. Magnezyum bromürün formülü, yüksek erime ve kaynama noktasına sahip, Mg+2 ile Bri- iyonları arasında güçlü bir iyonik bağa sahip iyonik bir bileşik olduğunu gösterir.
Magnezyum Bromür Molar Kütle
MgBr2’nin molar kütlesi 184.113 g/mol’dür. Magnezyum ve iki brom atomunun atomik kütlelerinin toplamıdır. Molar kütle, kimyasal hesaplamalarda çok önemli bir parametredir çünkü belirli bir numune miktarındaki bir maddenin mol sayısını belirlemeye yardımcı olur. MgBr2’nin molar kütlesi, kimyasal reaksiyonlar için gerekli bileşik miktarının belirlenmesinde hayati bir rol oynar.
Magnezyum bromürün kaynama noktası
MgBr2’nin kaynama noktası 1.204 santigrat derece veya 2.199 Fahrenheit derecedir. Bir bileşiğin kaynama noktası, buhar basıncının atmosfer basıncına eşit olduğu sıcaklıktır. MgBr2’nin yüksek kaynama noktası, onun yüksek sıcaklıklara ayrışmadan dayanabilen kararlı bir bileşik olduğunu gösterir. Bu özellik onu metalurji ve organik sentez reaksiyonları gibi yüksek sıcaklık uygulamalarında faydalı kılar.
Magnezyum bromürün erime noktası
MgBr2’nin erime noktası 714 santigrat derece veya 1.317 Fahrenheit derecedir. Bir bileşiğin erime noktası, onun katı halden sıvı hale geçtiği sıcaklıktır. MgBr2’nin yüksek erime noktası, güçlü moleküller arası kuvvetlere sahip kararlı bir bileşik olduğunu gösterir. Bu özellik, onu yüksek sıcaklıklardaki kimyasal reaksiyonlarda bir reaktif olarak faydalı kılar.
Magnezyum bromürün yoğunluğu g/mL
MgBr2’nin yoğunluğu 3,72 g/mL’dir. Yoğunluk, bir maddenin birim hacmi başına kütle miktarının bir ölçüsüdür. MgBr2’nin yüksek yoğunluğu, suda batabilen ağır bir bileşik olduğunu gösterir. Bu özellik onu inorganik sentez gibi çeşitli uygulamalarda ve tıpta sakinleştirici olarak faydalı kılar.
Magnezyum Bromür Molekül Ağırlığı
MgBr2’nin moleküler ağırlığı 184.113 g/mol’dür. Magnezyum ve iki brom atomunun atomik kütlelerinin toplamıdır. Molekül ağırlığı, bir bileşiğin kimyasal ve fiziksel özelliklerinin belirlenmesinde çok önemli bir rol oynar. MgBr2’nin moleküler ağırlığı, çeşitli solventlerdeki reaktivitesini ve çözünürlüğünü etkiler.
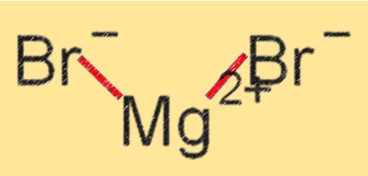
Magnezyum bromürün yapısı
MgBr2, Mg+2 ve Br- iyonlarının iyonik bağlarla bir arada tutulduğu bir kristal kafes yapısına sahiptir. Suda ve diğer polar çözücülerde yüksek oranda çözünebilen beyaz kristalli bir katıdır. MgBr2’nin kristal kafes yapısı, yüksek erime ve kaynama noktalarına ve ayrıca çeşitli kimyasal reaksiyonlardaki stabilitesine katkıda bulunur.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 3,72 gr/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 184.113 gr/mol |
| Yoğunluk | 3,72 gr/ml |
| Füzyon noktası | 714°C (1,317°F) |
| Kaynama noktası | 1204°C (2199°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çok çözünür |
| çözünürlük | Suda, etanolde, asetonda ve eterde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Doğal |
Magnezyum bromürün güvenliği ve tehlikeleri
MgBr2, doğru şekilde kullanıldığında genellikle güvenli kabul edilir. Ancak herhangi bir kimyasal bileşik gibi dikkatli kullanılmadığı takdirde tehlike oluşturabilir. MgBr2 aşındırıcıdır ve ciddi cilt ve göz tahrişine neden olabilir. MgBr2 tozunun veya dumanının solunması solunum yolu tahrişine neden olabilir. MgBr2 ile çalışırken koruyucu kıyafet ve solunum ekipmanı giymek önemlidir. MgBr2 ayrıca su veya asitler gibi bazı kimyasallarla şiddetli reaksiyona girerek hidrojen bromür gazı üretebilir. Bu nedenle MgBr2’nin uyumsuz maddelerden uzakta ve iyi havalandırılmış bir alanda saklanması ve işlenmesi çok önemlidir.
| Tehlike sembolleri | Aşındırıcı |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının. Koruyucu kıyafet ve solunum ekipmanı kullanın. Uyumsuz maddelerden uzak tutun ve saklayın. |
| BM kimlik numaraları | UN2920 |
| HS kodu | 2827.59.90 |
| Tehlike sınıfı | 8 |
| Paketleme grubu | II |
| Toksisite | Doğru şekilde kullanıldığında düşük toksisite. Cilt ve göz tahrişine neden olabilir. Toz veya dumanların solunması solunum yolu tahrişine neden olabilir. |
Magnezyum bromürün sentezi için yöntemler
MgBr2 çeşitli yöntemlerle sentezlenebilir.
Yaygın bir yöntem, metalik magnezyum ve hidrojen bromür gazı arasındaki reaksiyondur. Bu işlem, hidrojen bromür gazının Mg metali üzerinden geçirilmesini, MgBr2 ve hidrojen gazının üretilmesini içerir.
Diğer bir yöntem ise magnezyum oksit veya magnezyum hidroksit ile hidrobromik asit arasındaki reaksiyondur. Bu işlem ürün olarak MgBr2 ve su üretir.
Ek olarak MgBr2, magnezyum karbonat ile hidrobromik asit arasındaki reaksiyonla veya magnezyum sülfat ile NaBr arasındaki reaksiyonla sentezlenebilir.
Bu yöntemler, reaktiflerin karıştırılmasını ve reaksiyonun MgBr2 oluşumuyla sonuçlanacak şekilde ilerlemesine izin verilmesini içerir.
Magnezyum Bromürün Kullanım Alanları
MgBr2’nin çeşitli endüstrilerde çeşitli kullanımları vardır. Yaygın uygulamalarından bazıları şunlardır:
- Organik sentezde: Karbon-karbon bağlarının oluşumunu içeren Grignard reaksiyonu gibi organik sentez reaksiyonlarında Lewis asidi katalizörü olarak kullanılır.
- Alev geciktiricilerin üretiminde: Malzemeleri daha az yanıcı hale getiren alev geciktiriciler, üretimlerinde önemli bir bileşen olarak ona güvenirler.
- Petrol ve gaz endüstrisinde: Petrol ve gaz kuyularında basıncın korunmasına yardımcı olan ve kuyu çökmesini önleyen tamamlama sıvısı olarak kullanılır.
- Farmasötiklerde: sakinleştiriciler ve antikonvülzanlar gibi bazı farmasötik ürünlerde aktif madde olarak kullanılır.
- Elektrokimyada: Pillerde ve diğer elektrokimyasal cihazlarda elektrolit olarak kullanılır.
- Metal üretiminde: Alüminyum ve titanyum gibi bazı metallerin üretiminde eritken olarak kullanılır.
- Analitik kimyada: Analitik kimyada bor ve florür gibi çeşitli elementlerin belirlenmesi için reaktif olarak kullanılır.
Sorular:
S: Magnezyum bromürün kimyasal formülü nedir?
C: Magnezyum bromürün kimyasal formülü MgBr2’dir.
S: Magnezyum bromür iyonik mi yoksa kovalent mi?
C: MgBr2 iyonik bir bileşiktir.
S: Magnezyum bromürün formülü nedir?
C: Magnezyum bromürün formülü MgBr2’dir.
S: Magnezyum bromür suda çözünür mü?
C: Evet, MgBr2 suda çözünür. Suda çok çözünür ve berrak, renksiz bir çözelti oluşturacak şekilde çözünebilir.
S: Magnezyum bromürün formülü nedir?
C: Magnezyum bromürün formülü MgBr2’dir.
