Lityum karbonat (Li2CO3), duygudurum düzenleyici ilaçlarda kullanılan önemli bir bileşiktir. Bipolar bozukluğu tedavi eder ve depresyonun etkili bir şekilde yönetilmesine yardımcı olur, böylece genel zihinsel refahı artırır.
| IUPAC Adı | Lityum karbonat |
| Moleküler formül | Li2CO3 |
| CAS numarası | 554-13-2 |
| Eş anlamlı | Dilityum karbonat; Karbonik asit, dilityum tuzu; Lityum karbonat(1+); Karbonik asit, lityum tuzu (1:1) |
| InChI | InChI=1S/CH2O3.2Li/c2-1(3)4;;/h(H2,2,3,4);/q;2*+1/p-2 |
Lityum karbonatın özellikleri
Lityum Karbonat Formülü
Dilityum karbonatın formülü Li2CO3’tür. Bu, her molekülün iki lityum (Li) atomu, bir karbon (C) atomu ve üç oksijen (O) atomu içerdiği anlamına gelir. Bu kimyasal bileşim, özelliklerinde ve uygulamalarında çok önemli bir rol oynar.
Lityum Karbonat Molar Kütlesi
Dilityum karbonatın molar kütlesi yaklaşık 73,89 g/mol’dür. Formüldeki ilgili oranları dikkate alınarak, kendisini oluşturan elementlerin atom kütlelerinin eklenmesiyle hesaplanır. Bu değer, dilityum karbonat içeren çeşitli kimyasal hesaplamalar ve reaksiyonlar için gereklidir.
Lityum karbonatın kaynama noktası
Dilityum karbonatın yüksek bir kaynama noktası vardır; tipik olarak 1.310 santigrat derece (2.390 Fahrenheit derece). Bu sıcaklıkta bileşik sıvıdan gaza dönüşerek onu belirli endüstriyel prosesler ve uygulamalar için uygun hale getirir.
Lityum karbonat Erime noktası
Dilityum karbonatın nispeten düşük bir erime noktası vardır; tipik olarak 720 santigrat derece (1.328 Fahrenheit derece) civarındadır. Bu sıcaklıkta bileşik katı halden sıvı hale geçerek seramik, cam ve diğer malzemelerin yapımında kullanımını kolaylaştırır.
Lityum karbonatın yoğunluğu g/mL
Dilityum karbonatın yoğunluğu yaklaşık 2,11 g/mL’dir. Bu değer birim hacim başına kütlesini temsil eder ve parçacıkların bir arada ne kadar sıkı paketlendiğini gösterir. Dilityum karbonatın yoğunluğu, fiziksel özelliklerini ve davranışını anlamak için çok önemlidir.
Lityum Karbonat Molekül Ağırlığı
Dilityum karbonatın moleküler ağırlığı yaklaşık 73,89 g/mol’dür. Bu değer, bileşiğin bir molünün kütlesine karşılık gelir ve belirli bir madde miktarındaki mol sayısının belirlenmesi gibi çeşitli kimyasal hesaplamalarda esastır.
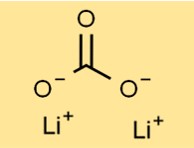
Lityum karbonatın yapısı
Dilityum karbonat beyaz, kokusuz bir toz oluşturan kristal bir yapıya sahiptir. Düzeneği, iyonik bağlarla bir arada tutulan Li+ katyonları ve karbonat anyonlarından (CO3^2-) oluşur. Bu spesifik düzenleme bileşiğin stabilitesine ve reaktivitesine katkıda bulunur.
Lityum karbonatın çözünürlüğü
Dilityum karbonatın suda çözünürlüğü sınırlıdır. Bir dereceye kadar çözünür ve hafif alkali bir çözelti oluşturur. Dilityum karbonatın çözünürlüğü, farmasötik formülasyonlarda ve kontrollü çözünmenin gerekli olduğu diğer uygulamalarda kritik bir husustur.
| Dış görünüş | Beyaz, kokusuz toz |
| Spesifik yer çekimi | 2,11g/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 73,89 gr/mol |
| Yoğunluk | 2,11g/ml |
| Füzyon noktası | 720°C (1328°F) |
| Kaynama noktası | 1310°C (2390°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Sınırlı çözünürlük |
| çözünürlük | Suda çözünür, hafif alkali bir çözelti oluşturur |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Müsait değil |
| pH | Hafif alkali |
Lityum karbonatın güvenliği ve tehlikeleri
Dilityum karbonat dikkatli kullanım gerektiren potansiyel güvenlik tehlikeleri oluşturur. Ciltle doğrudan temas tahrişe neden olabilir, yutulması ise mide-bağırsak rahatsızlığına neden olabilir. Aşırı maruz kalınması durumunda sinir sistemi üzerinde zararlı etkileri tetikleyebilir. Potansiyel tehlikelerden kaçınmak için, kullanım sırasında koruyucu ekipman giymek gibi uygun güvenlik önlemlerine uyulmalıdır. Dilityum karbonatın uyumsuz maddelerden ve ısı veya alev kaynaklarından uzakta depolanması ve taşınması çok önemlidir. Acil durumlarda derhal tıbbi yardıma başvurun. Dilityum karbonatla çalışırken güvenlik veri sayfaları ve yönergeleri dikkatle incelenmeli ve bunlara uyulmalıdır.
| Tehlike sembolleri | Aşındırıcı, Tahriş Edici |
| Güvenlik Açıklaması | Tahrişe neden olabilir. Yutmaktan kaçının. Yeterli havalandırmayla kullanın. Koruyucu ekipman giyin. |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 2836.40.00 |
| Tehlike sınıfı | Tehlikeli olarak sınıflandırılmadı |
| Paketleme grubu | sınıflandırılmamış |
| Toksisite | Düşük toksisite |
Lityum karbonat sentez yöntemleri
Dilityum karbonatın sentezlenmesi için farklı yöntemler mevcuttur.
Yaygın bir yaklaşım, lityum hidroksit veya lityum oksit gibi lityum bileşiklerini kontrollü koşullar altında karbondioksite tabi tutmaktır. Reaksiyon, yan ürün olarak lityum karbonat ve su üretir. Başka bir yöntem, lityum klorür gibi çözünür lityum tuzlarının , çözünür bir karbonat bileşiğiyle karıştırılmasını içerir. Reaksiyon, araştırmacıların ayırıp toplayabileceği katı bir lityum karbonat çökeltisi oluşturur.
Ayrıca lityum bikarbonatın termal ayrışmasıyla da dilityum karbonat üretmek mümkündür. Lityum bikarbonat ısıtıldığında lityum karbonata ayrışır ve karbondioksit ve su açığa çıkar. Bazı endüstriyel ortamlar bu işlemi yüksek saflıkta lityum karbonat elde etmek için kullanır.
İstenilen verim ve saflık seviyelerini elde etmek için, kullanılan yönteme bakılmaksızın sıcaklık, basınç ve stokiyometri gibi reaksiyon parametrelerinin uygun şekilde kontrol edilmesi gerekir. Dilityum karbonatın sentezi, bu bileşiğin farmasötikler, seramikler ve piller dahil olmak üzere çeşitli uygulamalara yönelik üretiminde hayati bir rol oynar.
Lityum karbonatın kullanım alanları
Dilityum karbonat benzersiz özelliklerinden dolayı çeşitli uygulamalar bulur. İşte ana kullanımları:
- İlaçlar: Duygudurum düzenleyici ilaçların önemli bir bileşenidir, bipolar bozukluğu ve depresyonu etkili bir şekilde tedavi eder ve zihinsel sağlığı destekler.
- Piller: Şarj edilebilir lityum iyon pillerde dilityum karbonat, lityum bileşiklerinin öncüsü olarak görev yapar ve enerji depolama teknolojilerinde çok önemli bir rol oynar.
- Piroteknik: Dilityum karbonatın belirli kimyasallarla ekzotermik reaksiyonu, onu havai fişeklerde ve işaret fişeklerinde değerli kılar.
- Kimyasal sentez: Lityum iyonlarının kaynağı olarak çeşitli kimyasal reaksiyonlarda ve organik sentezlerde gereklidir.
- Alkali Metallerin Kaynağı: Alkali metallerin özelliklerini incelemek için kullanılan laboratuvarlarda ve araştırmalarda lityum kaynağı görevi görür.
- Çevresel Uygulamalar: Dilityum karbonat, su arıtma proseslerinde pH’ın düzenlenmesine, asitlik ve alkaliliğin kontrol edilmesine yardımcı olur.
- Seramik ve cam: Dilityum karbonat, eritici madde olarak görev yaparak seramik ve cam ürünlerin stabilitesini artırır, böylece erime sıcaklıklarını düşürür.
- Metalurji: Metalurjide dilityum karbonat, alüminyum ve bakır gibi metalleri rafine ederek yabancı maddeleri etkili bir şekilde giderir ve mekanik özelliklerini geliştirir.
- Klima: Klima sistemlerindeki kurutucular, nemi etkili bir şekilde emmek ve optimum klima performansı sağlamak için dilityum karbonat kullanır.
Genel olarak dilityum karbonatın geniş uygulama yelpazesi, endüstrilerdeki önemini vurgulayarak onu modern teknoloji, tıp ve malzeme biliminde değerli bir bileşik haline getiriyor.
Sorular:
Soru: Aşağıdaki elementlerden hangisinin değerlik elektronu en azdır?
C: Berilyum yalnızca iki taneyle en az değerlik elektronuna sahiptir.
S: Lityum karbonat ne için kullanılır?
C: Dilityum karbonat, bipolar bozukluğu ve depresyonu tedavi etmek için duygudurum dengeleyici ilaçlarda kullanılır.
S: Dilityum karbonat çözünür mü?
C: Evet, dilityum karbonat suda sınırlı ölçüde çözünür.
S: Lityum karbonat nasıl çalışır?
C: Dilityum karbonat, ruh halini dengeleyerek ve beyindeki nörotransmiterleri dengeleyerek çalışır.
S: Lityum karbonat neyi tedavi eder?
C: Dilityum karbonat psikiyatrik tıpta bipolar bozukluğu ve depresyonu tedavi etmek için kullanılır.
S: LiNO3 iyonik mi yoksa kovalent mi?
C: LiNO3 iyoniktir.
Soru: Aşağıdakilerden hangisi suda çözünmez? Li2CO3, NaOH, PbCl2, Ba(OH)2, (NH4)2S.
C: PbCl2 ve Ba(OH)2 suda çözünmez.
S: Li2CO3 suda çözünür mü?
C: Li2CO3 suda az çözünür.
S: Li2CO3’te kaç iyon var?
C: Li2CO3 üç iyon içerir: iki Li+ iyonu ve bir CO3^2- iyonu.
S: 0,0067 g Li2CO3’te kaç formül birimi bulunur?
C: 0,0067 g Li2CO3’te yaklaşık 1,24 x 10^20 formül birimi bulunur.
S: 30,0 ml 0,600 M Li2CO3 çözeltisinde kaç tane lityum iyonu bulunur?
A: 30,0 ml 0,600 M Li2CO3 çözeltisinde 0,036 mol Li+ iyonu vardır.
S: Lityum karbonat Li2CO3’teki karbonun kütlesel yüzde bileşimi nedir?
C: Li2CO3’teki karbonun kütle yüzdesi bileşimi yaklaşık %11,3’tür.
S: Aşağıdaki sulu çözelti çiftlerinden hangisi NH4NO3 + Li2CO3 karıştırıldığında çökelti oluşturacaktır?
C: NH4NO3 + Li2CO3 her iki bileşik de suda çözünebildiği için çökelti oluşturmaz.
