Kurşun oksit (PbO), kurşun ve oksijenden oluşan bir bileşiktir. Farklı özellikleri ve kullanım alanları nedeniyle pil, seramik ve cam üretiminde kullanılmaktadır.
| IUPAC Adı | Kurşun(II) oksit |
| Moleküler formül | PbO |
| CAS numarası | 1317-36-8 |
| Eş anlamlı | Kurşun monoksit, kurşun (II) oksit, litarj |
| InChI | InChI=1S/2O.Pb |
Kurşun oksidin özellikleri
Kurşun Oksit Formülü
Kurşun monoksitin kimyasal formülü PbO’dur. Basit, iyi tanımlanmış bir moleküler yapı ile sonuçlanan bir kurşun (Pb) atomu ve bir oksijen (O) atomundan oluşur.
Kurşun Oksit Molar Kütlesi
Kurşun monoksitin (PbO) molar kütlesi mol başına yaklaşık 223,2 gramdır (g/mol). Bu değer, bir kurşun atomunun ve bir oksijen atomunun atomik kütlelerinin eklenmesiyle elde edilir.
Kurşun oksidin kaynama noktası
Kurşun monoksitin kaynama noktasına ulaşmadan önce ayrışmaya uğraması nedeniyle belirgin bir kaynama noktası yoktur. Isıtıldığında metalik kurşun ve oksijen gazına dönüşür.
Kurşun oksidin erime noktası
Kurşun monoksitin (PbO) erime noktası yaklaşık 888°C’dir (1,630°F). Bu sıcaklıkta katı kurşun monoksit erimiş bir sıvıya dönüşerek çeşitli endüstriyel uygulamaları kolaylaştırır.
Kurşun oksit yoğunluğu g/mL
Kurşun monoksitin yoğunluğu mililitre başına yaklaşık 9,53 gramdır (g/mL). Bu yüksek yoğunluk, seramik ve cam üretimi gibi çeşitli endüstrilerde faydalı olmasını sağlar.
Kurşun Oksit Molekül Ağırlığı
Kurşun monoksitin (PbO) moleküler ağırlığı 223,2 g/mol’dür. Bu değer, tek bir kurşun monoksit molekülündeki kurşun ve oksijenin atomik kütlelerinin toplamını temsil eder.
Kurşun oksidin yapısı
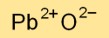
Kurşun monoksit kristal bir kafes yapısına sahiptir; kurşun katyonları (Pb2+) kafes üzerindeki pozisyonları işgal eder ve oksit anyonları (O2-) ara boşlukları doldurur. Bu düzenleme kararlı bir iyonik bağla sonuçlanır.
Kurşun oksidin çözünürlüğü
Kurşun monoksitin (PbO) suda çözünürlüğü düşüktür. Suda çok az çözünür ve kurşun katyonlarının hidrolizi yoluyla bazik bir çözelti oluşturur. Asidik ortamlarda çözünürlüğü artabilir.
| Dış görünüş | Sarı veya kırmızı toz |
| Spesifik yer çekimi | 9,53 gr/ml |
| Renk | Sarı veya kırmızı |
| Koku | Kokusuz |
| Molar kütle | 223,2 g/mol |
| Yoğunluk | 9,53 gr/cm³ |
| Füzyon noktası | 888°C (1630°F) |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Az çözünür |
| çözünürlük | Düşük çözünürlük, asidik ortamlarda artabilir |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Uygulanamaz |
| pH | Temel (sulu çözeltide) |
Kurşun Oksit Güvenliği ve Tehlikeleri
Kurşun monoksit potansiyel güvenlik tehlikeleri oluşturur ve dikkatli kullanım gerektirir. Kurşun monoksit tozunun veya buharının solunması veya yutulması, sinir sistemini ve organları olumsuz yönde etkileyerek kurşun zehirlenmesine yol açabilir. Bu bileşiği kullanırken yeterli havalandırma ve kişisel koruyucu ekipman şarttır. Tahrişi önlemek için gözlere, cilde veya giysilere temasından kaçının. Ayrıca kurşun monoksit sudaki yaşama ve çevreye zararlıdır; su kütlelerine deşarjından kesinlikle kaçınılmalıdır. Riskleri en aza indirmek için uygun depolama ve imha yöntemleri takip edilmelidir. Kurşun monoksitle çalışırken daima güvenlik talimatlarına ve düzenleyici önlemlere uyun.
| Tehlike sembolleri | Sağlık tehlikesi |
| Güvenlik Açıklaması | – Solunması veya yutulması kurşun zehirlenmesine ve organ hasarına neden olabilir. – Tahrişi önlemek için göz ve cilt ile temasından kaçının. – Yeterli havalandırma ve kişisel koruyucu ekipmanla taşıyın. Çevreye salınmasından kaçının. Güvenlik talimatlarını izleyin. |
| BM kimlik numaraları | UN3077 |
| HS kodu | 2824.90.7000 |
| Tehlike sınıfı | 9 (Çeşitli tehlikeli maddeler ve nesneler) |
| Paketleme grubu | III |
| Toksisite | Sudaki yaşam için uzun süreli etkilerle toksiktir. |
Kurşun Oksit Sentez Yöntemleri
Kurşun monoksitin sentezi çeşitli yöntemleri içerir. Yaygın bir yaklaşım, kurşun nitratın (Pb(NO3)2) belirli bir sıcaklığa ısıtıldığı kurşun nitratın termal ayrışmasını içerir. Bu işlem kurşun nitratı kurşun monoksit (PbO), nitrojen dioksit (NO2) ve oksijen gazına (O2) ayırır. Kimyasal reaksiyon şunları temsil eder:
2 Pb(NO3)2 → 2 PbO + 4 NO2 + O2
Başka bir yöntem metalik kurşunun oksidasyonunu içerir. Metalik kurşun oksijenle reaksiyona girerek kurşun monoksit üretir:
2 Pb + O2 → 2 PbO
Ayrıca kurşunun asidik koşullarda korozyona maruz kalması kurşun monoksit oluşumuna neden olur. Bu senaryoda kurşun oksijen ve suyla reaksiyona girerek kurşun monoksit üretir:
2 Pb + 2 H2O + O2 → 2 PbO + 2 H2O
Bu yöntemler, pil, seramik ve pigment üretimi gibi çeşitli uygulamalara yönelik kurşun monoksit üretimi için çok önemlidir. Ancak potansiyel sağlık ve çevresel riskleri nedeniyle kurşun bileşiklerinin dikkatli bir şekilde kullanılması önemlidir.
Kurşun oksit kullanımı
Kurşun monoksit, benzersiz özellikleri nedeniyle çeşitli endüstrilerde çeşitli uygulamalar bulur. Yaygın kullanımları şunlardır:
- Seramik: Seramik üretiminde bir akış görevi görerek seramik malzemelerin erime özelliklerini ve genel kalitesini artırır.
- Radyasyondan Korunma: Yüksek yoğunluğu ve radyasyonu absorbe etme verimliliği, kurşun monoksiti tıbbi tesislerde ve nükleer endüstrilerde radyasyondan korunma için uygun bir malzeme haline getirir.
- PVC Stabilizatör: Polivinil klorürün (PVC) işlenmesinde ısı stabilizatörü ve yağlayıcı olarak işlev görür ve PVC boru, kablo ve diğer ürünlerin imalatına yardımcı olur.
- Yarı iletken cihazlar: Aşırı gerilim koruması için kullanılan kurşun monoksit varistörler gibi bazı yarı iletken cihazlarda malzeme görevi görür.
- Kurşun-asit aküler: Kurşun-asit aküler, kurşun monoksiti temel bir bileşen olarak kullanır ve onlara araçlarda, yedek güç kaynaklarında ve kesintisiz güç kaynaklarında kullanım için gerekli özellikleri verir.
- Cam Üretimi: Kurşun monoksit, kurşun camın üretiminde hayati bir rol oynar, ona artırılmış kırılma indeksi ve parlaklık kazandırır, bu da onu dekoratif ve optik amaçlar için ideal hale getirir.
- Pigment Uygulaması: Boya ve kaplamalar, canlı renkleri ve hava koşullarına dayanıklılıkları nedeniyle minium (Pb3O4) gibi çeşitli kurşun bazlı pigmentlerden yararlanır.
- Kauçuk endüstrisinde kullanım: Kauçuk endüstrisi, kauçuk ürünlerinin özelliklerini ve dayanıklılığını etkili bir şekilde geliştiren hızlandırıcı ve vulkanizasyon maddesi olarak kurşun monoksit kullanır.
Kurşun monoksitin önemli endüstriyel uygulamaları olmasına rağmen, potansiyel sağlık ve çevresel riskleri nedeniyle dikkatli bir şekilde kullanılması önemlidir. Çeşitli endüstrilerde sorumlu kullanımını sağlamak için uygun güvenlik önlemleri ve düzenlemeler gereklidir.
Sorular:
Soru: Aşağıdakilerden hangisi kurşun(IV) oksidin bozunmasını temsil eden dengeli bir denklemdir?
C: Kurşun(IV) oksidin ayrışması için dengeli denklem PbO2 → PbO + O2’dir.
S: Kurşun(IV) oksidin kimyasal formülü nedir?
C: Kurşun(IV) oksidin kimyasal formülü PbO2’dir.
Soru: 86,5 gram potasyum iyodürden kaç gram kurşun(II) oksit üretilecektir?
C: Üretilen kurşun(II) oksidin gramını belirlemek için potasyum iyodür ve PbO içeren bir kimyasal reaksiyon denklemine ihtiyacımız var.
S: Kurşun monoksit nedir?
C: Kurşun monoksit, kurşun ve oksijen içeren herhangi bir bileşiği ifade eder ve kurşun(II) oksit (PbO) ve kurşun(IV) oksit (PbO2) dahil olmak üzere çeşitli formlarda bulunur.
Soru: 0,632 mol kurşun, kurşun(II) nitrata oksitlendi. Kaç mol gümüş biriktirilecek?
C: Biriken gümüşün mol sayısını hesaplamak için kurşun(II) nitratın gümüşe indirgenmesini temsil eden dengeli bir kimyasal denkleme ihtiyacımız var.
S: PbO’nun adı nedir?
C: PbO’nun adı kurşun(II) oksittir.
Soru: Kurşunun oksidasyon numarası nedir?
C: Kurşunun oksidasyon sayısı PbO’da +2, PbO2’de ise +4’tür.
S: PbO amfoterik midir?
C: Hayır, PbO amfoterik değildir; asidik veya bazik özellikler göstermez.
S: PbO nedir?
C: PbO, kurşun-asit piller ve cam üretimi de dahil olmak üzere çeşitli uygulamalarda kullanılan bir bileşik olan kurşun(II) oksidin kimyasal formülüdür.
S: Pb(NO3)2 = PbO + NO2 + O2 denklemi nasıl dengelenir?
A: Kurşun(II) nitratın (Pb(NO3)2) ayrışması için dengeli denklem 2Pb(NO3)2 = 2PbO + 4NO2 + O2’dir.
