Kükürt diklorür (SCl₂), kükürt ve klorun birleştirilmesiyle oluşan kimyasal bir bileşiktir. Çeşitli endüstrilerde boya, kauçuk ve pestisit yapımında kullanılır.
| IUPAC Adı | Kükürt diklorür |
| Moleküler formül | SCl₂ |
| CAS numarası | 10545-99-0 |
| Eş anlamlı | Klor monosülfür, kükürt klorür, kükürt diklorür, kükürt klorür, diklorosülfan |
| InChI | InChI=1S/Cl2S/c1-3-2 |
Kükürt diklorürün özellikleri
Kükürt diklorür formülü
Sülfür klorürün formülü SCl₂’dir. Bir kükürt atomu ve iki klor atomunun birleşimini temsil eder. Bu kimyasal formül, bileşiğin bileşimini ve yapısını doğru bir şekilde yansıtır.
Kükürt Diklorür Molar Kütlesi
Sülfür klorürün molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Sülfürün molar kütlesi 32,06 g/mol ve klorun molar kütlesi 35,45 g/mol’dür. İki klor atomu ve bir kükürt atomunun kütleleri toplandığında kükürt klorürün molar kütlesinin yaklaşık 102,91 g/mol olduğu belirlenir.
Kükürt diklorürün kaynama noktası
Kükürt klorürün kaynama noktası 138,8°C’dir (281,8°F). Bu sıcaklık, standart atmosferik basınç altında sıvı bileşiğin gaz haline dönüştüğü noktayı gösterir. Kükürt klorürü taşırken veya çeşitli uygulamalarda kullanırken kaynama noktasını dikkate almak önemlidir.
Kükürt diklorür Erime noktası
Sülfür klorürün erime noktası -76,8°C’dir (-106,2°F). Bu sıcaklık katı bileşiğin sıvı duruma geçtiği noktayı temsil eder. Kükürt klorürle çalışırken uygun kullanım ve depolamayı sağlamak için erime noktasının bilinmesi önemlidir.
Sülfür diklorürün yoğunluğu g/mL
Kükürt klorürün yoğunluğu yaklaşık 1,64 g/mL’dir. Yoğunluk değeri, maddenin birim hacmi başına kütle miktarını gösterir. Bu özellik, kükürt klorürün kimyasal reaksiyonlar sırasındaki gibi farklı bağlamlardaki davranışını ve özelliklerini anlamak veya belirli uygulamalara uygunluğunu belirlemek için gereklidir.
Kükürt Diklorür Molekül Ağırlığı
Sülfür klorürün moleküler ağırlığı yaklaşık 102,91 g/mol’dür. Bileşen elementlerinin atomik kütlelerinin eklenmesiyle hesaplanan bileşik molekülünün toplam kütlesini temsil eder. Molekül ağırlığı, bileşiğin kütlesi hakkında değerli bilgiler sağlar ve çeşitli kimyasal hesaplamalarda hassas ölçümlere olanak tanır.
Kükürt diklorürün yapısı
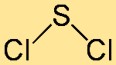
Sülfür klorürün yapısı en iyi şekilde kavisli veya V şeklinde bir molekül olarak tanımlanır. İki klor atomuna bağlı merkezi bir kükürt atomundan oluşur. Atomların düzeni ve bağ açıları, bileşiğin genel stabilitesine ve reaktivitesine katkıda bulunur.
Sülfür diklorürün çözünürlüğü
Kükürt klorürün suda çözünürlüğü sınırlıdır. Az çözünür ve su ile karıştırıldığında bulanık bir çözelti oluşturma eğilimindedir. Bileşiğin çözünürlük özelliklerinin, diğer maddelerle uyumluluğunun ve farklı çözücüler içindeki davranışının belirlenmesinde dikkate alınması önemlidir.
| Dış görünüş | Sarı sıvı |
| Spesifik yer çekimi | 1,64 gr/ml |
| Renk | SARI |
| Koku | Dönüm |
| Molar kütle | 102,91 gr/mol |
| Yoğunluk | 1,64 gr/ml |
| Füzyon noktası | -76,8°C |
| Kaynama noktası | 138,8°C |
| Flaş noktası | Müsait değil |
| sudaki çözünürlük | Tepki verir |
| çözünürlük | Buzlu asetik asit, benzen, bromda çözünür |
| Buhar basıncı | 35,4 mmHg |
| Buhar yoğunluğu | 3,9 (hava=1) |
| pKa | Müsait değil |
| pH | Müsait değil |
Sülfür diklorürün güvenliği ve tehlikeleri
Kükürt klorür çeşitli güvenlik riskleri oluşturur ve dikkatli kullanılmalıdır. Çok aşındırıcıdır ve ciltle, gözlerle veya mukozayla teması halinde ciddi yanıklara neden olabilir. Buharlarının solunması solunum sistemini tahriş edebilir ve öksürüğe, nefes almada zorluğa ve akciğer hasarına neden olabilir. Aynı zamanda yanıcıdır ve bazı maddelerin varlığında tutuşabilir. Kükürt klorür ile çalışırken eldiven, gözlük ve solunum koruması gibi uygun koruyucu ekipmanlar kullanılmalıdır. Kazaları ve olası hasarları önlemek için bu bileşiğin iyi havalandırılmış bir alanda, tutuşma kaynaklarından ve uyumsuz malzemelerden uzakta kullanılması ve saklanması önemlidir.
| Tehlike sembolleri | Aşındırıcı |
| Güvenlik Açıklaması | Temastan kaçının, koruyucu ekipman kullanın, iyi havalandırılmış alanlarda çalışın |
| BM kimlik numaraları | 1828 |
| HS kodu | 2812.10.00 |
| Tehlike sınıfı | 8 (Aşındırıcı maddeler) |
| Paketleme grubu | II |
| Toksisite | Çok zehirli |
Sülfür diklorürün sentezi için yöntemler
Sülfür klorürün sentezlenmesi için çeşitli yöntemler vardır. Yaygın bir yaklaşım, kükürt ve klor gazı arasındaki reaksiyonu içerir. Bu proseste, kükürt belirli bir sıcaklığa, genellikle 200-250°C (392-482°F) civarına ısıtıldığında fazla miktarda klor bulunur. Reaksiyon kükürt klorür oluşturmak üzere ilerler.
Başka bir yöntem, tiyonil klorür (SOCl₂) ile kükürt arasındaki reaksiyonu içerir. Tiyonil klorür, kükürt ile reaksiyona girerek kükürt klorür üreten bir klor kaynağı görevi görür. Bu reaksiyon, doğrudan kükürt-klor yöntemine göre nispeten daha düşük bir sıcaklıkta meydana gelir.
Sülfüril klorür (SO₂Cl₂) ile hidrojen sülfit (H₂S) arasındaki reaksiyon, sülfür klorürün hazırlanmasına olanak sağlar. Bu reaksiyon yüksek sıcaklıklarda meydana gelir ve kükürt klorür ve diğer yan ürünleri üretir.
İlgili personelin güvenliğini sağlamak için kükürt klorür sentezinin iyi donanımlı laboratuvarlarda veya endüstriyel ortamlarda gerçekleştirilmesi çok önemlidir. Bileşiğin tehlikeli yapısından dolayı personelin koruyucu ekipman giymesi ve iyi havalandırılan alanlarda çalışması dahil uygun güvenlik önlemlerine uyması gerekir.
Sentez yönteminin seçimi, ham maddelerin mevcudiyeti, ürünün istenen saflığı ve özel uygulama gereklilikleri dahil olmak üzere çeşitli faktörlere bağlıdır. Her yöntemin kendine özgü avantajları ve hususları olduğundan, uygun tekniğin seçilmesi prosesin veya uygulamanın özel ihtiyaçlarına bağlıdır.
Kükürt diklorürün kullanım alanları
Sülfür klorür (SCl₂), kendine özgü özellikleri nedeniyle çeşitli endüstrilerde ve proseslerde uygulama alanı bulur. Sülfür klorürün bazı önemli kullanım alanları şunlardır:
- Boya İmalatı: Üreticiler, tekstil endüstrisindeki kumaşlara canlı renkler veren, özellikle kükürt boyaları olmak üzere boyalar üretmek için kükürt klorür kullanır.
- Kauçuk Endüstrisi: Kauçuk endüstrisi, polimer zincirlerini çapraz bağlayarak kauçuk ürünlerinin mukavemetini ve elastikiyetini arttırmak için SCl₂’yi vulkanizasyon maddesi olarak kullanır.
- Pestisitlerin sentezi: Kükürt klorür, bazı pestisitlerin sentezinde çok önemli bir rol oynar ve organofosfat bileşikleri ve organotiyofosfatlar olarak adlandırılan insektisit ve fungisitlerin üretimini sağlar.
- Kimyasal sentez: SCl₂, çeşitli kimyasal reaksiyonlarda çok yönlü bir reaktif olarak hizmet eder ve alkollerin alkil klorürlere dönüştürülmesi veya klorlu organik bileşiklerin sentezi gibi klorlama reaksiyonlarını mümkün kılar.
- Laboratuvar Reaktifi: Laboratuvarlar, organik sentez, kükürt kimyası ve inorganik reaksiyonlar dahil olmak üzere birçok uygulama için reaktif olarak kükürt klorür kullanır.
- Su Arıtma: Su arıtma süreçlerinde, su kaynaklarından zararlı mikroorganizmaları ve organik kirleticileri uzaklaştırmak için dezenfektan ve oksitleyici madde olarak SCl₂ kullanılır.
- İlaç endüstrisi: Kükürt klorür, farmasötik araştırma ve geliştirmede, özellikle belirli aktif farmasötik bileşenlerin (API) sentezinde uygulama alanı bulur.
- Kimyasal analiz: Gaz kromatografisi gibi analitik kimya teknikleri, belirli bileşikleri tespit etmek ve analiz etmek için SCl₂’yi kullanır.
Bu çeşitli uygulamalar, çeşitli endüstriyel işlemlerde ve bilimsel çabalarda kükürt klorürün önemini vurgulamaktadır. Bununla birlikte, tehlikeli yapısından dolayı kükürt klorürün uygun güvenlik kurallarına ve prosedürlerine uygun olarak dikkatli bir şekilde işlenmesi ve kullanılması önemlidir.
Sorular:
S: Sülfür diklorürün formülü nedir?
C: Sülfür klorürün formülü SCl₂’dir.
S: Sülfür diklorürün moleküler bileşiğini hangi formül temsil eder?
A: Moleküler bileşik kükürt klorür SCl₂ formülüyle temsil edilir.
S: Kükürt diklorür polar mıdır?
C: Evet, kükürt klorür, kavisli moleküler geometri ve eşit olmayan elektron yoğunluğu dağılımı nedeniyle polardır.
S: Sülfür diklorür SCl₂’de S ve Cl arasındaki sigma bağını hangi atomik veya hibrit yörüngeler oluşturur?
C: Kükürt klorürde (SCl₂) kükürt (S) ve klor (Cl) arasındaki sigma bağı, kükürtün 3p yörüngesi ile klorun 3p yörüngesinin örtüşmesiyle oluşur.
S: SCl₂ doğrusal mıdır?
C: Hayır, kükürt klorür (SCl₂) doğrusal değildir. Kavisli veya V şeklinde bir moleküler geometriye sahiptir.
Soru: Aşağıdakilerden hangisi iyonik bileşiktir? Cl₂O, CH₂O, SCl₂, PF₅, Mg₃(PO₄)₂.
C: Listelenen bileşiklerin hiçbiri iyonik bileşik değildir. Bunlar ya moleküler bileşiklerdir (Cl₂O, CH₂O, SCl₂, PF₅) ya da inorganik bir fosfat bileşiğidir (Mg₃(PO₄)₂).
S: SCl₂ formülüne sahip bileşiğin adı nedir?
C: SCl₂ formülüne sahip bileşiğe kükürt klorür denir.
S: SCl₂’nin formu nedir?
C: SCl₂ kavisli veya V şeklinde bir moleküler şekle sahiptir.
S: SCl₂’nin moleküler geometrisi nedir?
C: SCl₂’nin moleküler geometrisi kavisli veya V şeklindedir.
S: SCl₂’de kükürt tarafından kullanılan hibrit yörüngelerin adları nelerdir?
C: SCl₂’deki kükürt atomu sp² hibrit yörüngelerini kullanır.
S: Bir kükürt atomu iki klor atomu ile birleşerek SCl₂ oluşturduğunda ne olur?
C: Bir kükürt atomu iki klor atomu ile birleştiğinde kükürt klorür olarak bilinen SCl₂ bileşiğini oluşturur. Kükürt atomu, aralarında kovalent bir bağ oluşturmak için elektronları klor atomlarıyla paylaşır.
