Kromik asit olarak da bilinen krom trioksit, CrO3 formülüne sahip inorganik bir bileşiktir. Kromik asidin asit anhidritidir ve bazen aynı isimle pazarlanmaktadır.
| IUPAC Adı | Krom(VI)oksit |
| Moleküler formül | CrO3 |
| CAS numarası | 1333-82-0 |
| Eş anlamlı | Kromik anhidrit, krom oksit anhidrit, trioksokrom Krom (VI) oksit |
| InChI | InChI=1S/Cr.3O |
Krom trioksitin özellikleri
Krom trioksit formülü
Kromik anhidritin formülü CrO3’tür. Üç oksijen atomuna bağlı bir krom atomundan oluşur.
Krom Trioksit Molar Kütlesi
Kromik anhidrürün molar kütlesi, krom (Cr) ve oksijen (O) olan kurucu elementlerinin atomik kütlelerinin eklenmesiyle hesaplanır. Molar kütle yaklaşık 99,994 g/mol’dür.
Krom trioksitin kaynama noktası
Kromik anhidritin belirgin bir kaynama noktası yoktur. Isıtıldığında sıvı faza geçmeden krom oksit ve oksijen gazına ayrışır.
Krom trioksitin erime noktası
Kromik anhidrürün erime noktası yaklaşık 196°C’dir. Bu sıcaklıkta katı halden sıvı hale geçer.
Krom trioksitin yoğunluğu g/mL
Kromik anhidrürün yoğunluğu yaklaşık 2,7 g/mL’dir. Bu değer, bileşiğin birim hacim başına kütlesini temsil eder.
Krom Trioksit Molekül Ağırlığı
Molar kütle olarak da adlandırılan kromik anhidrürün moleküler ağırlığı yaklaşık 99.994 g/mol’dür. Bileşikteki krom ve oksijen atomlarının atom kütlelerinin toplamıdır.
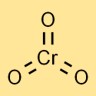
Krom trioksitin yapısı
Kromik anhidrit, bir krom atomunun merkezi olarak üç oksijen atomuna bağlandığı moleküler bir yapıya sahiptir. Merkezde krom atomu ve köşelerde oksijen atomları bulunan dört yüzlü bir geometriyi benimser.
Krom trioksitin çözünürlüğü
Kromik anhidrit suda oldukça çözünür. Kolayca çözünür ve bir kromik asit çözeltisi oluşturur. Kromik anhidrürün sudaki çözünürlüğü, onun çeşitli kimyasal işlemlerde ve uygulamalarda kullanılmasına olanak sağlar.
| Dış görünüş | Koyu kırmızı kristaller |
| Spesifik yer çekimi | 2.7g/ml |
| Renk | Koyu Kırmızı |
| Koku | Kokusuz |
| Molar kütle | 99.994 gr/mol |
| Yoğunluk | 2.7g/ml |
| Füzyon noktası | 196°C |
| Kaynama noktası | ayrıştırılmış |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çok çözünür |
| çözünürlük | Etanol, eter vb. gibi çeşitli çözücülerde çözünür. |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Asit (çözelti halinde) |
Krom trioksitin güvenliği ve tehlikeleri
Kromik anhidrit önemli güvenlik riskleri oluşturur ve dikkatle kullanılmalıdır. Oldukça aşındırıcı ve oksitleyici bir maddedir; ciltte, gözlerde ve solunum sisteminde ciddi yanıklara neden olabilir. Kromik anhidrürün solunması veya yutulması solunum sıkıntısına, mide-bağırsak sorunlarına ve hatta organ hasarına neden olabilir.
Kromik anhidrit ile çalışırken eldiven, gözlük ve solunum cihazı dahil uygun kişisel koruyucu ekipman (PPE) giyilmelidir. Uyumsuz malzemelerden ve tutuşturucu kaynaklardan uzakta, serin ve kuru bir yerde saklanmalıdır.
Tehlikeli bir atık olarak kabul edildiğinden, kromik anhidrürün imhası yerel düzenlemelere uygun olarak gerçekleştirilmelidir. Çevreye salınmamalıdır.
| Tehlike sembolleri | Aşındırıcı, Oksitleyici |
| Güvenlik Açıklaması | Ciltle, gözlerle temasından ve solunmasından kaçının. Uygun koruyucu ekipman kullanın. |
| BM kimlik numaraları | BM 1463 |
| HS kodu | 2819.90.90 |
| Tehlike sınıfı | 5.1 (Oksitleyici madde) |
| Paketleme grubu | II |
| Toksisite | Çok zehirli |
Krom trioksit sentez yöntemleri
Kromik anhidritin sentezlenmesi için çeşitli yöntemler vardır.
Yaygın bir yöntem, sodyum dikromat ve sülfürik asit arasındaki reaksiyonu içerir. Kontrollü bir ortamda birisi sodyum dikromat (Na2Cr2O7) ile konsantre sülfürik asidi (H2SO4) karıştırır. Reaksiyon, yan ürün olarak koyu kırmızı bir kromik anhidrit (CrO3) ve sodyum sülfat (Na2SO4) çözeltisinin oluşmasıyla sonuçlanır.
Başka bir yöntem, krom(III) bileşiklerinin , hidrojen peroksit (H2O2) veya nitrik asit (HNO3) gibi güçlü oksitleyici maddeler kullanılarak oksidasyonunu içerir. Bu işlemde, krom(III)’ü kromik anhidrite dönüştürmek için krom(III) bileşiğini oksitleyici maddeyle belirli koşullar altında karıştırın.
Metalik krom veya krom(II) bileşiklerini potasyum permanganat (KMnO4) veya potasyum dikromat (K2Cr2O7) gibi güçlü oksitleyici maddelerle reaksiyona sokarak kromik anhidrit hazırlayın. Reaksiyon kromik anhidrit oluşumuna yol açar.
Kromik anhidrit sentezinin uygun güvenlik önlemleriyle ve ilgili düzenlemelere uygun olarak gerçekleştirilmesi gerektiğine dikkat etmek önemlidir. Güvenliği sağlamak ve çevresel etkileri en aza indirmek için deneyimli kişilerin sentez sürecini iyi donanımlı laboratuvarlarda yürütmesi gerekmektedir.
Krom Trioksitin Kullanım Alanları
Kromik anhidrit, organik bileşiklerin üretimi de dahil olmak üzere çeşitli kimyasal işlemlerde oksitleyici bir madde olarak uygulama alanı bulur.
- Üreticiler bunu krom sarısı ve krom yeşili gibi boyalar ve pigmentler üretmek için kullanıyor.
- Elektrokaplama endüstrisi, kromu metal yüzeylere kaplamak için kullanır, korozyon direnci ve çekici bir görünüm sağlar.
- Plastik ve sentetik malzemelerin üretiminde polimerizasyon reaksiyonları için krom katalizörlerinin hazırlanmasında kullanılır.
- Farmasötiklerin ve organik ara maddelerin sentezinde rol oynar.
- Ahşap koruyucu tedaviler, çürümeye ve zararlılara karşı koruma sağlamak için onu mantar ilacı ve böcek ilacı olarak kullanır.
- Laboratuvarlar bunu çeşitli kimyasal testler ve analizler için reaktif olarak kullanır.
- Özel cam ve seramik üretiminde kullanımı renkleri ve spesifik özellikleri geliştirir.
- Tabaklama endüstrisi bunu deriyi işlemek, postların stabilize edilmesine ve boyanmasına yardımcı olmak için kullanır.
- Metal yüzeylere yönelik temizlik maddelerinin ve yüzey işlemlerinin formülasyonunda yer alan bir bileşendir.
Toksik ve aşındırıcı yapısından dolayı kromik anhidritin dikkatli bir şekilde kullanılması önemlidir. Uygun güvenlik protokollerine uygunluk, kullanımı ve imhası sırasında insanların ve çevrenin korunmasını sağlar.
Sorular:
S: CrO3 nedir?
C: CrO3, üç oksijen atomuna bağlı bir krom atomundan oluşan bir bileşik olan kromik anhidrittir.
S: CrO3 güçlü bir oksitleyici madde midir?
C: Evet, CrO3, çeşitli bileşiklerin oksidasyonunu kolaylaştırmak için kimyasal reaksiyonlarda yaygın olarak kullanılan güçlü bir oksitleyici maddedir.
S: CrO3 alkole ne yapar?
C: CrO3 alkolleri oksitleyebilir ve bunları aldehitler veya ketonlar gibi karşılık gelen karbonil bileşiklerine dönüştürebilir.
S: 1-pentanolün CrO3, H2O ve H2SO4 ile reaksiyonundan hangi organik ürünü elde edersiniz?
C: Reaksiyon, bir keton olan organik ürün 1-pentanonu verecektir.
S: Aşağıdaki dönüşümü gerçekleştirmek için en iyi reaktif seçimi nedir: PCC, HIO4, CrO3, NaOH?
C: Bu dönüşüm için en iyi reaktif seçimi PCC (piridinyum klorokromat) olacaktır.
S: CrO3 amfoterik midir?
C: Hayır, CrO3 amfoterik değildir. Çok asidik bir bileşiktir ancak temel özellikleri gösteremez.
S: CrO3’teki Cr’nin oksidasyon sayısı nasıl bulunur?
C: Cr’nin CrO3’teki oksidasyon sayısı +6’dır.
S: CrO3’ün adı nedir?
C: CrO3’ün adı kromik anhidrittir.
S: CrO3 anonik olmayan alkollere ne yapar?
C: CrO3, anonik olmayan alkolleri oksitleyebilir ve bunları, anonik olmayan ketonlar gibi karşılık gelen karbonil bileşiklerine dönüştürebilir.
S: CrO3’teki geçiş metali katyonunun yükü nedir?
C: CrO3’teki krom olan geçiş metali katyonunun yükü +6’dır.
