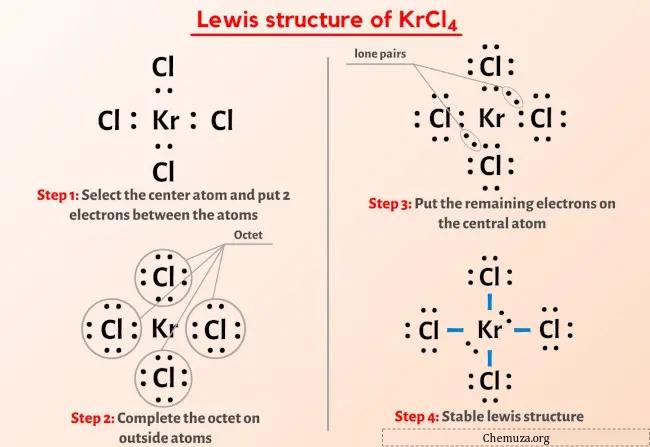
Yukarıdaki görseli zaten gördünüz değil mi?
Yukarıdaki görseli kısaca açıklayayım.
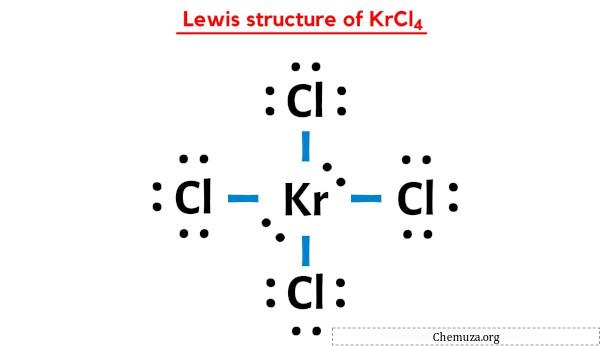
KrCl4 Lewis yapısının merkezinde dört klor (Cl) atomu ile çevrelenmiş bir Kripton (Kr) atomu bulunur. Kripton atomu (Kr) ile her klor atomu (Cl) arasında 4 tekli bağ vardır. Kripton (Kr) atomunda 2 yalnız çift, dört klor (Cl) atomunda ise 3 yalnız çift bulunur.
KrCl4’ün Lewis yapısının yukarıdaki görüntüsünden hiçbir şey anlamadıysanız, benimle kalın ve KrCl4’ün Lewis yapısının nasıl çizileceğine dair ayrıntılı adım adım açıklamayı alacaksınız.
O halde KrCl4’ün Lewis yapısını çizme adımlarına geçelim.
KrCl4 Lewis Yapısını Çizim Adımları
Adım 1: KrCl4 molekülündeki toplam değerlik elektronu sayısını bulun
Bir KrCl4 molekülündeki toplam değerlik elektronu sayısını bulmak için öncelikle kripton atomunda ve klor atomunda bulunan değerlik elektronlarını bilmeniz gerekir.
(Değerlik elektronları herhangi bir atomun en dış yörüngesinde bulunan elektronlardır.)
Burada periyodik tablo kullanarak kriptonun ve klorun değerlik elektronlarını nasıl kolayca bulacağımı açıklayacağım.
KrCl4 molekülündeki toplam değerlik elektronları
→ Kripton atomunun verdiği değerlik elektronları:
Kripton periyodik tablonun 18. grubunda yer alan bir elementtir.[1] Bu nedenle kriptonda bulunan değerlik elektronları 8’dir .
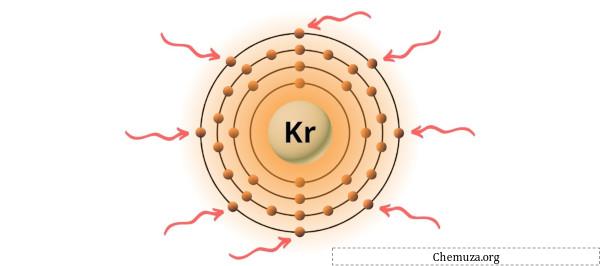
Yukarıdaki resimde gösterildiği gibi kripton atomunda bulunan 8 değerlik elektronunu görebilirsiniz.
→ Klor atomunun verdiği değerlik elektronları:

Klor periyodik tablonun 17. grubunda yer alan bir elementtir. [2] Bu nedenle klorda bulunan değerlik elektronları 7’dir .
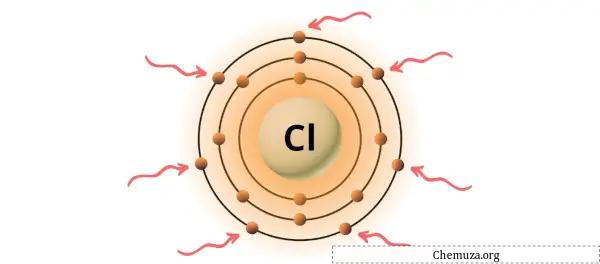
Yukarıdaki resimde gösterildiği gibi klor atomunda bulunan 7 değerlik elektronunu görebilirsiniz.
Bu yüzden,
KrCl4 molekülündeki toplam değerlik elektronları = 1 kripton atomu tarafından bağışlanan değerlik elektronları + 4 klor atomu tarafından bağışlanan değerlik elektronları = 8 + 7(4) = 36 .
Adım 2: Merkez atomu seçin
Merkez atomu seçmek için en az elektronegatif atomun merkezde kaldığını unutmamalıyız.
Şimdi burada verilen molekül KrCl4’tür ve kripton (Kr) atomları ve klor (Cl) atomları içerir.
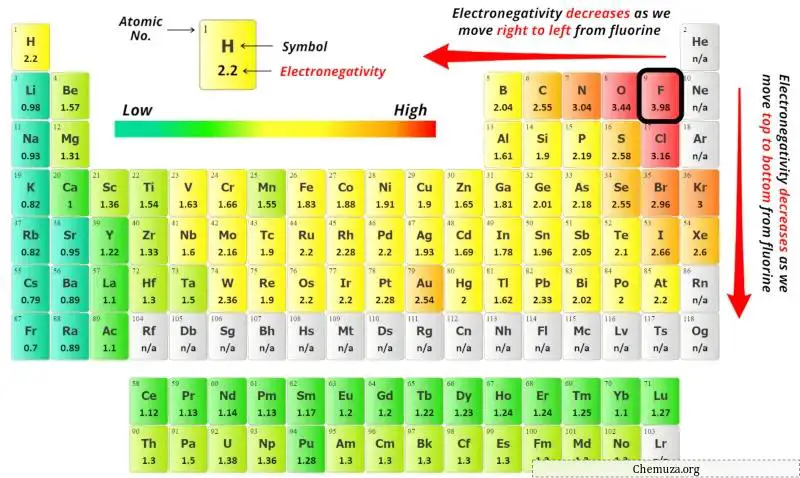
Yukarıdaki periyodik tabloda kripton atomunun (Kr) ve klor atomunun (Cl) elektronegatiflik değerlerini görebilirsiniz.
Kriptonun (Kr) ve klorun (Cl) elektronegatiflik değerlerini karşılaştırırsak kripton atomunun elektronegatifliği daha azdır .
Burada kripton (Kr) atomu merkez atom, klor (Cl) atomları ise dış atomlardır.
Adım 3: Her atomu aralarına bir çift elektron yerleştirerek bağlayın
Şimdi KrCl4 molekülünde elektron çiftlerini kripton atomu (Kr) ile klor atomları (Cl) arasına koymalıyız.
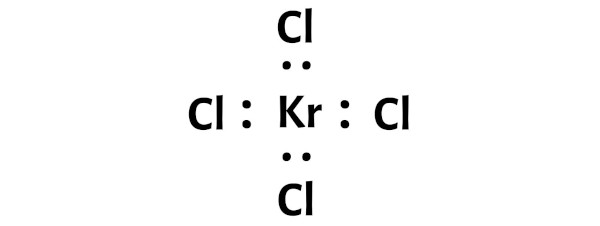
Bu, kripton (Kr) ve klorun (Cl) bir KrCl4 molekülünde birbirine kimyasal olarak bağlandığını gösterir.
Adım 4: Dış atomları kararlı hale getirin. Kalan değerlik elektron çiftini merkez atomun üzerine yerleştirin.
Bu adımda dış atomların kararlılığını kontrol etmeniz gerekir.
Burada KrCl4 molekülünün çiziminde dıştaki atomların klor atomları olduğunu görebilirsiniz.
Bu harici klor atomları bir oktet oluşturur ve bu nedenle stabildir.
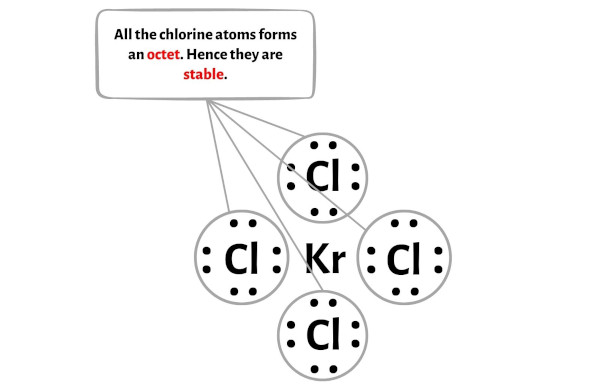
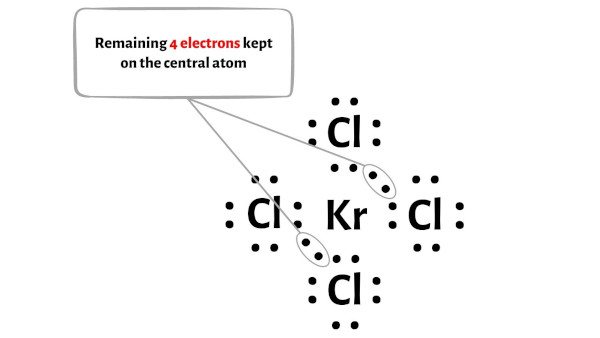
Ek olarak 1. adımda KrCl4 molekülünde bulunan toplam değerlik elektronu sayısını hesapladık.
KrCl4 molekülünde toplam 36 değerlik elektronu vardır ve yukarıdaki diyagramda bunlardan sadece 32 değerlik elektronu kullanılmıştır.
Yani kalan elektron sayısı = 36 – 32 = 4 .
Bu 4 elektronu yukarıdaki şemada KrCl4 molekülünün merkezi kripton atomuna yerleştirmeniz gerekiyor.
Şimdi bir sonraki adıma geçelim.
Adım 5: Lewis yapısının kararlılığını kontrol edin
Artık KrCl4’ün Lewis yapısının stabilitesini kontrol etmeniz gereken son adıma geldiniz.
Lewis yapısının kararlılığı formal yük kavramı kullanılarak doğrulanabilir.
Kısacası artık KrCl4 molekülünde bulunan klor (Cl) atomlarının yanı sıra kripton (Kr) atomlarının da formal yükünü bulmamız gerekiyor.
Resmi vergiyi hesaplamak için aşağıdaki formülü kullanmanız gerekir:
Resmi yük = Değerlik elektronları – (Bağ elektronları)/2 – Bağ yapmayan elektronlar
Aşağıdaki görüntüde KrCl4 molekülünün her bir atomu için bağlanan elektronların ve bağlanmayan elektronların sayısını görebilirsiniz.
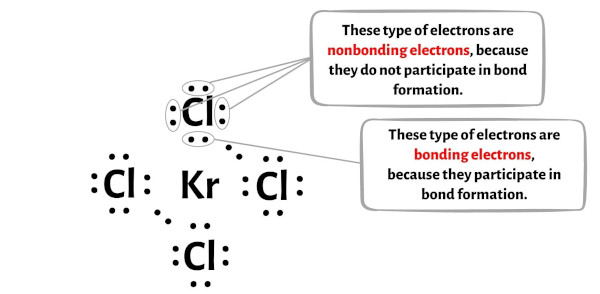
Kripton atomu (Kr) için:
Değerlik elektronları = 8 (çünkü kripton 18. gruptadır)
Bağ elektronları = 8
Bağlanmayan elektronlar = 4
Klor atomu (Cl) için:
Elektron değeri = 7 (çünkü klor 17. gruptadır)
Bağ elektronları = 2
Bağlanmayan elektronlar = 6
| Resmi suçlama | = | değerlik elektronları | – | (Elektronların bağlanması)/2 | – | Bağlanmayan elektronlar | ||
| Kr. | = | 8 | – | 8/2 | – | 4 | = | 0 |
| Cl | = | 7 | – | 2/2 | – | 6 | = | 0 |
Yukarıdaki formal yük hesaplamalarından kripton (Kr) atomunun ve klor (Cl) atomunun “sıfır” formal yüke sahip olduğunu görebilirsiniz.
Bu, KrCl4’ün yukarıdaki Lewis yapısının stabil olduğunu ve KrCl4’ün yukarıdaki yapısında başka bir değişiklik olmadığını gösterir.
KrCl4’ün yukarıdaki Lewis nokta yapısında, her bir bağ elektronu çiftini (:) tek bir bağ (|) olarak da temsil edebilirsiniz. Bunu yapmak KrCl4’ün aşağıdaki Lewis yapısına yol açacaktır.
Umarım yukarıdaki tüm adımları tamamen anlamışsınızdır.
Daha fazla pratik yapmak ve daha iyi anlamak için aşağıda listelenen diğer Lewis yapılarını deneyebilirsiniz.
Daha iyi anlamak için şu Lewis yapılarını deneyin (veya en azından görün):
