Klor heptoksit veya Cl2O7 oldukça patlayıcı ve reaktif bir bileşiktir. Organik madde ile teması halinde şiddetli bir şekilde ayrışabilir ve kimyasal sentez ve analizlerde kullanılan güçlü bir oksitleyici maddedir.
| IUPAC Adı | Klor heptoksit |
| Moleküler formül | Cl2O7 |
| CAS numarası | 12015-53-1 |
| Eş anlamlı | Perklorik anhidrit, diklor heptoksit, klor (VII) oksit, klor oksit, perkloril perklorat |
| InChI | InChI=1S/Cl2O7/c2-1(3,4,5,6)10-7(8,9)11-12-13-14-10 |
Klor Heptoksit molar kütlesi
Kimyasal formülü Cl2O7 olan klor heptoksitin molar kütlesi 182,9 g/mol’dür. Bu bileşik iki klor atomu ve yedi oksijen atomundan oluşur ve bu da onu oldukça oksitleyici bir madde yapar. Klor heptoksidin molar kütlesi, Avogadro sabiti kullanılarak bir numunenin belirli bir kütlesi veya hacmindeki madde miktarını hesaplamak için kullanılır.
Klor heptoksidin kaynama noktası
Klor heptoksit renksiz ila sarımsı, oldukça reaktif ve uçucu bir katıdır. Klor heptoksitin kaynama noktası, kaynama noktasına ulaşmadan ayrıştığı için iyi tanımlanmamıştır. Klor heptoksit, organik madde, su ve diğer maddelerle reaksiyona girerek patlayıcı bileşikler oluşturabilen güçlü bir oksitleyici maddedir.
Klor heptoksitin erime noktası
Klor heptoksitin erime noktası -96°C’dir (-141°F), bu da onu düşük erime noktalı bir katı yapar. Klor heptoksit, düşük erime noktası ve yüksek reaktivitesi nedeniyle oda sıcaklığında sarımsı bir sıvı olarak bulunabilir. Ağır yanıklara neden olabileceğinden ve güçlü bir oksitleyici madde olduğundan, klor heptoksitin dikkatle kullanılması önemlidir.
Klor heptoksitin yoğunluğu g/ml
Klor heptoksidin yoğunluğu oda sıcaklığında 2,48 g/mL’dir. Klor heptoksitin yüksek yoğunluğu, onu bir kabın dibine hızla batabilen yoğun bir sıvı haline getirir. Klor heptoksidin yüksek yoğunluğu ve reaktivitesi, işlenmesi zor bir bileşik haline getirir ve kimyasal sentez veya analizde kullanıldığında özel güvenlik önlemleri gerektirir.
Klor Heptoksidin Moleküler Ağırlığı
Bağıl moleküler kütle olarak da bilinen klor heptoksitin moleküler ağırlığı 182,9 g/mol’dür. Klor heptoksitin moleküler ağırlığı, madde miktarı, kütle ve hacmi içeren kimyasal hesaplamalarda önemlidir. Klor heptoksitin yüksek moleküler ağırlığı, onu dikkatli kullanım ve depolama gerektiren yoğun, uçucu bir bileşik haline getirir.
Klor heptoksitin yapısı
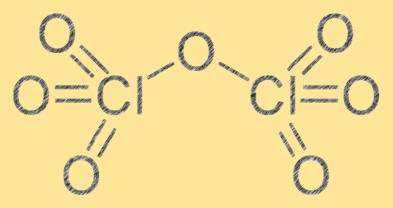
Klor heptoksitin yapısı iki klor atomu ve yedi oksijen atomundan oluşur. Cl2O7 moleküler formülüne sahiptir ve moleküler geometrisi, oksijen atomları arasındaki itme nedeniyle çarpık bir oktahedral şekildir. Klor heptoksit güçlü bir oksitleyici maddedir ve çeşitli organik ve inorganik maddelerle reaksiyona girebilir. Klor heptoksidin yapısı, kimyasal özelliklerini ve farklı reaksiyonlardaki davranışını anlamak için gereklidir.
Klor heptoksit formülü
Klor heptoksitin kimyasal formülü Cl2O7’dir. Formül, her klor heptoksit molekülünün iki klor atomu ve yedi oksijen atomu içerdiğini gösterir. Formül, klor heptoksit içeren kimyasal reaksiyonların stokiyometrisini hesaplamak için kullanılır. Klor heptoksitin formülü aynı zamanda molekül ağırlığının, yoğunluğunun ve diğer fiziksel ve kimyasal özelliklerinin belirlenmesinde de önemlidir.
| Dış görünüş | Renksiz ila sarımsı katı |
| Spesifik yer çekimi | 25°C’de 2,48 |
| Renk | Renksiz ila sarımsı |
| Koku | Baharatlı, ekşi |
| Molar kütle | 182,9 g/mol |
| Yoğunluk | 25°C’de 2,48 g/mL |
| Füzyon noktası | -96°C (-141°F) |
| Kaynama noktası | Kaynama noktasından önce ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suyla şiddetli reaksiyona girer |
| çözünürlük | Organik çözücülerde çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Müsait değil |
| pH | Uygulanamaz |
Klor heptoksitin güvenliği ve tehlikeleri
Klor heptoksit, uygun şekilde kullanılmadığı takdirde önemli güvenlik riskleri oluşturan oldukça reaktif ve tehlikeli bir bileşiktir. Temas halinde ciddi yanıklara, gözlerde, ciltte ve solunum sisteminde hasara neden olabilir. Klor heptoksit ayrıca su ve organik maddelerle şiddetli reaksiyona girerek patlamalara ve yangın tehlikelerine neden olabilir. Klor heptoksitle çalışırken eldiven, gözlük ve solunum cihazı dahil uygun kişisel koruyucu ekipmanın kullanılması önemlidir. Bileşik, tutuşma kaynaklarından, ısıdan veya nemden uzakta, güvenli, sıkıca kapatılmış bir kapta saklanmalı ve taşınmalıdır. Klor heptoksit ile ilişkili riskleri en aza indirmek için uygun kullanım prosedürleri ve güvenlik önlemleri takip edilmelidir.
| Tehlike sembolleri | Oksitleyici madde, aşındırıcı |
| Güvenlik Açıklaması | Su, asitler, organik maddeler ve indirgeyici maddelerle temasından kaçının. Uygun kişisel koruyucu ekipman kullanın. Isıdan, nemden ve tutuşturucu kaynaklardan uzakta, sıkıca kapatılmış bir kapta saklayın. Göz, cilt veya solunum sistemi ile teması halinde derhal tıbbi yardıma başvurun. |
| BM kimlik numaraları | BM 3083 |
| HS kodu | 28299090 |
| Tehlike sınıfı | 5.1 (Oksitleyici malzemeler) |
| Paketleme grubu | II |
| Toksisite | Solunması, yutulması veya cilt tarafından emilmesi halinde çok toksiktir. Ciddi yanıklara ve doku hasarına neden olur. Su, organik maddeler ve diğer reaktif maddelerle teması halinde patlama ve yangın tehlikesine neden olabilir. |
Klor heptoksitin sentezi için yöntemler
Klor heptoksit oldukça reaktif bir bileşiktir ve sentezlenmesi zordur.
Klor heptoksiti sentezlemenin en yaygın yöntemlerinden biri, klor gazı ve ozonun reaksiyona sokulmasıdır. Bu reaksiyon ekzotermiktir ve dikkatli bir şekilde kontrol edilmezse patlayıcı bir reaksiyona yol açabilir.
Başka bir yöntem, klor gazının, yan ürünler olarak klor heptoksit ve potasyum klorür üreten potasyum klorat ile reaksiyonunu içerir. Bu yöntem ayrıca patlayıcı ara maddelerin oluşumunu önlemek için reaksiyon koşullarının dikkatli bir şekilde kontrol edilmesini gerektirir.
Klor heptoksit, klor gazının, yan ürünler olarak klor heptoksit ve diklor heksoksit üreten diklor pentoksit ile reaksiyona sokulmasıyla sentezlenebilir. Ancak araştırmacılar, diklorin pentoksidin tehlikeli yapısından dolayı bu yöntemi yaygın olarak kullanmamaktadır.
Klor heptoksidi sentezlemenin diğer yöntemleri arasında, klor gazının kontrollü koşullar altında benzen veya toluen gibi çeşitli organik bileşiklerle reaksiyona sokulması yer alır. Bununla birlikte, bu yöntemler reaksiyon koşullarının dikkatli bir şekilde optimize edilmesini gerektirir ve klor-ozon veya klor-potasyum klorat yöntemleri kadar güvenilir değildir veya yaygın olarak kullanılmamaktadır.
Genel olarak klor heptoksitin sentezi, reaksiyon koşullarının dikkatli bir şekilde kontrol edilmesini gerektirir ve bileşiğin oldukça reaktif doğasından dolayı önemli güvenlik riskleri sunar. Klor heptoksit veya diğer tehlikeli maddelerle çalışırken güvenlik önlemlerine ve uygun kullanım prosedürlerine uyulmalıdır.
Klor Heptoksitin Kullanım Alanları
- Cl2O7 ana kullanımını kimyasal sentez ve araştırmalarda oksitleyici bir madde olarak bulur.
- Çok çeşitli organik ve inorganik bileşiklerle reaksiyona girerek güçlü bir oksidan görevi görür ve birçok kimyasal reaksiyonda faydalı olmasını sağlar.
- Cl2O7’nin en yaygın kullanımlarından biri, su arıtımında, kağıt hamuru ve kağıt üretiminde ve tekstil imalatında kullanılan güçlü bir dezenfektan ve ağartma maddesi olan klor dioksitin üretimidir.
- Ayrıca farmasötikler ve tarım kimyasalları da dahil olmak üzere birçok organik bileşiğin sentezinde güçlü bir oksidan olarak kullanılır.
- Cl2O7, akademik çevrede ve çeşitli organik ve inorganik bileşiklerin reaktivitesini incelemek için yapılan araştırmalarda kullanılır. Ayrıca epoksi reçineler ve asetik anhidrit gibi bazı bileşiklerin sentezinde katalizör görevi görür.
- Tehlikeli doğasından dolayı büyük ölçekli endüstriyel uygulamalarda genellikle Cl2O7 kullanılmaz. Patlayıcı ara maddelerin ve diğer güvenlik tehlikelerinin oluşmasını önlemek için dikkatli kullanım ve depolama gerektirir.
Genel olarak Cl2O7, kimyasal sentez ve araştırmalarda yararlı bir bileşiktir ancak kullanımıyla ilişkili riskleri en aza indirmek için güvenlik önlemleri ve uygun kullanım prosedürleri gerektirir.
Sorular:
S: Cl2O7 nedir?
A: Cl2O7, iki klor atomu ve yedi oksijen atomundan oluşan, Cl2O7 kimyasal formülüne sahip kimyasal bir bileşiktir.
S: Cl2O7’nin doğru adı nedir?
C: Cl2O7’nin doğru adı diklorin heptoksittir.
S: Cl2O7 iyonik mi yoksa kovalent mi?
Cevap: Cl2O7 kovalent bir bileşiktir. Metalik olmayan iki elementten (klor ve oksijen) oluşur ve atomlar arasında elektron paylaşımı yoluyla moleküler bir bileşik oluşturur.
Soru: Aşağıdaki hangi oksit su ile reaksiyona girerek zayıf bir asit oluşturur? MgO, Cl2O7, P4O10, Bi2O3, N2O5.
C: Su ile reaksiyona girerek zayıf asit oluşturan oksit N2O5’tir. N2O5 su ile reaksiyona girdiğinde zayıf bir asit olan nitrik asit oluşturur. Listelenen diğer oksitler (MgO, P4O10, Bi2O3 ve Cl2O7) suyla reaksiyona girerek zayıf asitler oluşturmaz.
