Klor (Cl2) çok reaktif yeşilimsi sarı bir gazdır. Su arıtımında, dezenfektan olarak, PVC ve solventler gibi çeşitli kimyasalların üretiminde kullanılır.
| IUPAC Adı | Diklor |
| Moleküler formül | Cl2 |
| CAS numarası | 7782-50-5 |
| Eş anlamlı | Moleküler klor, Klor, Cloro, Klor, Kloor, Cloreto de cloro |
| InChI | InChI=1S/Cl2/c1-2 |
Cl2 Molar kütle
Cl2’nin veya klorun molar kütlesi, iki klor atomunun atomik kütlelerinin toplamı veya 70.906 g/mol’dür. Bir kimyasal reaksiyon için gereken madde miktarını hesaplarken veya farklı ölçü birimleri arasında dönüşüm yaparken Cl2’nin molar kütlesini bilmek önemlidir.
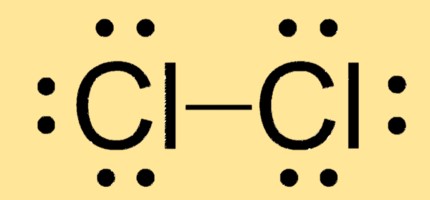
Lewis yapısı Cl2
Cl2, tek bir kovalent bağ ile bağlanan iki klor atomu ile doğrusal bir moleküler geometriye sahiptir. Lewis yapısı, her biri üç yalnız çift içeren iki Cl atomundan ve aralarında paylaşılan bir elektron çiftinden oluşur.
Kaynama noktası Cl2
Cl2’nin kaynama noktası standart basınçta -34,04°C’dir (-29,27°F). Bu, oda sıcaklığında ve basınçta gaz halinde Cl2 üreten nispeten düşük bir kaynama noktasıdır. Düşük sıcaklık ve basınçta kolayca sıvıya veya katıya dönüşebildiği için Cl2’yi kullanırken dikkatli olmak önemlidir.
Cl2 Erime noktası
Cl2’nin erime noktası standart basınçta -101,5°C’dir (-150,7°F). Bu, oda sıcaklığında ve basınçta gaz halinde Cl2 üreten nispeten düşük bir erime noktasıdır. Düşük sıcaklık ve basınçta kolayca sıvıya veya katıya dönüşebildiği için Cl2’yi kullanırken dikkatli olmak önemlidir.
Cl2 Yoğunluğu g/ml
Cl2’nin yoğunluğu standart sıcaklık ve basınçta (STP) 0,003214 g/mL’dir. Bu, Cl2’nin havadan çok daha az yoğun olduğu ve atmosfere yükseleceği anlamına gelir. Cl2 basınçlı silindirlerde veya nitrojen gibi havadan ağır gazlar içeren tanklarda depolanabilir.
Klorun moleküler ağırlığı
Cl2’nin moleküler ağırlığı 70.906 g/mol’dür. Bu, Avogadro sayısı kadar (6,022 x 10^23) molekül içeren bir mol Cl2’nin kütlesidir. Cl2’nin moleküler ağırlığı kimyadaki stokiyometrik hesaplamalar için önemlidir.
Klorun yapısı
Cl2’nin yapısı doğrusaldır ve iki klor atomu kovalent bir bağla birbirine bağlanmıştır. İki klor atomu arasındaki bağ uzunluğu 1,99 Ångstrom ve bağ enerjisi 242 kJ/mol’dür. Cl2’nin elektronik konfigürasyonu [Ne]3s23p5’tir ve her klor atomu bağ çiftine bir elektron katkıda bulunur.
Klor formülü
Cl2’nin formülü basitçe birbirine bağlı iki Cl atomudur. Bu Cl-Cl veya Cl2 ile temsil edilir. Formül, bir bileşiğin veya molekülün bileşimini tanımlamak ve kimyadaki stokiyometrik hesaplamalar için önemlidir.
| Dış görünüş | Yeşilimsi sarı gaz |
| Spesifik yer çekimi | 1,56 (sıvı) |
| Renk | yeşilimsi sarı |
| Koku | Keskin ve boğucu bir koku |
| Molar kütle | 70.906 gr/mol |
| Yoğunluk | STP’de 0,003214 g/mL |
| Füzyon noktası | -101,5°C (-150,7°F) |
| Kaynama noktası | -34,04°C (-29,27°F) |
| Flaş noktası | Yanıcı değil |
| sudaki çözünürlük | 20°C’de 0,92 g/100 mL |
| çözünürlük | Suda, etanolde, eterde, benzende ve birçok organik çözücüde çözünür |
| Buhar basıncı | 20°C’de 102,44 kPa |
| Buhar yoğunluğu | 2,49 (hava = 1) |
| pKa | – |
| pH | – |
Cl2 Güvenlik ve tehlikeler
Klor, uygun şekilde kullanılmadığı takdirde ciddi güvenlik ve sağlık riskleri oluşturabilecek oldukça reaktif bir gazdır. Ciddi solunum yolu tahrişine ve gözlerde, ciltte ve mukoza zarlarında hasara neden olabilir. Yüksek konsantrasyonda klorun solunması yaşamı tehdit edebilecek akciğer ödemine neden olabilir. Klor ayrıca çok aşındırıcıdır ve metallere, plastiklere ve diğer malzemelere zarar verebilir. Klorun güvenli bir şekilde kullanılmasını sağlamak için gözlük, eldiven ve solunum cihazı gibi uygun kişisel koruyucu ekipmanlar giyilmelidir. Klor yalnızca iyi havalandırılan alanlarda kullanılmalı ve tüm kaplar uygun şekilde etiketlenmeli ve güvenli bir yerde saklanmalıdır.
| Tehlike sembolleri | Kurukafa ve kırık kemikler |
| Güvenlik Açıklaması | Son derece zehirli ve aşındırıcı gaz; ciddi solunum ve cilt tahrişine neden olur; yüksek konsantrasyonlarda solunması halinde ölümcül olabilir |
| BM kimlik numaraları | UN1017 |
| HS kodu | 2801.1 |
| Tehlike sınıfı | 2.3 |
| Paketleme grubu | BEN |
| Toksisite | Çok zehirli; yüksek konsantrasyonların solunması akciğer ödemine neden olabilir ve ölümcül olabilir |
Klor sentez yöntemleri
Tuzlu su elektrolizi, HCl oksidasyonu ve metal klorürlerin termal ayrışması dahil olmak üzere klor gazının sentezlenmesi için çeşitli yöntemler vardır.
En yaygın yöntem, bir elektrik akımının sodyum klorür (NaCl) ve su (H2O) çözeltisinden geçirilmesini içeren tuzlu su elektrolizidir. Bu işlem anotta klor gazı ve katotta hidrojen gazı üretir.
Klor üretmenin başka bir yöntemi, HCl’nin KMnO4 veya MnO2 gibi bir oksitleyici madde ile oksidasyonudur. Bu reaksiyon yan ürün olarak klor gazı ve su üretir.
MgCl2 veya FeCl3 gibi metal klorürlerin termal ayrışması, klor gazı üretmenin başka bir yöntemidir. Bu işlem, metal klorürün yüksek bir sıcaklığa ısıtılmasını içerir, bu da onun ayrışmasına ve klor gazı salmasına neden olur.
Genel olarak klor için kullanılan sentez yöntemi, spesifik uygulamaya ve gazın istenen saflığına bağlıdır. Kullanılan yöntem ne olursa olsun, klorun oldukça reaktif ve toksik yapısından dolayı dikkatli bir şekilde kullanılması önemlidir.
Klorun kullanım alanları
Klor gazının çeşitli endüstrilerde geniş bir kullanım alanı vardır. Klorun ana kullanım alanlarından biri, yaygın olarak kullanılan bir plastik malzeme olan polivinil klorürün (PVC) üretimidir. Klor ayrıca çözücü olarak kullanılan kloroform ve karbon tetraklorür gibi diğer klor bileşiklerinin üretiminde ve soğutucuların üretiminde de kullanılır.
Su arıtma endüstrisinde klor, içme suyu ve atık suların arıtılmasında dezenfektan olarak yaygın olarak kullanılır. Klor gazı bakteri ve virüsleri öldürmede etkilidir ve aynı zamanda sudaki organik bileşikleri ve diğer kirletici maddeleri oksitleyip uzaklaştırabilir.
Kağıt hamuru ve kağıt endüstrisinde, kağıt ürünlerini beyazlatmak için ağartma maddesi olarak klor gazı kullanılır. Naylon ve polyester gibi tekstillerin üretiminde, boya ve pigment üretiminde de kullanılır.
Klor gazının ayrıca, özellikle bazı farmasötik ürünlerin üretiminde ve metal yüzeylerin soyulması ve temizlenmesi için metalurji endüstrisinde başka uygulamaları da vardır. Ancak klorun tehlikeli yapısı nedeniyle dikkatli bir şekilde taşınması ve depolanması, taşınması ve kullanımı sırasında uygun güvenlik önlemlerinin alınması gerekir.
Sorular:
S: Cl2 polar mı yoksa polar değil mi?
C: Cl2 polar olmayan bir moleküldür.
Soru: Klor bir metal midir?
C: Hayır, klor bir metal değildir. Halojendir ve metalik olmayan elementler grubuna aittir.
Soru: Sofra tuzu oluşturmak için hangi yumuşak metal klorla birleşir?
C: Sodyum (Na), sofra tuzu (NaCl) üretmek için klor (Cl) ile birleşen yumuşak metaldir.
S: Su nasıl klorlanır?
C: Suyun klorlanması genellikle su kaynağına ölçülü miktarda klor gazı, sodyum hipoklorit veya kalsiyum hipoklorit eklenerek yapılır. Eklenen klor miktarı suyun kalitesine ve istenen dezenfeksiyon seviyesine bağlıdır. Klor, sudaki bakterilerle ve diğer mikroorganizmalarla reaksiyona girerek onları etkili bir şekilde öldürür ve suyu içilebilir hale getirir.
Soru: Ağartma tozu elde etmek için aşağıdakilerden hangisi klor ile muamele edilir?
A: Kalsiyum oksit (CaO), ağartma tozu (CaOCl2) elde etmek için klor (Cl2) ile işlenir.
