Karbon tetraklorür, tatlı bir kokuya sahip, renksiz bir sıvıdır. Yaygın olarak solvent olarak kullanılmış ancak sağlığa ve çevreye zararlı etkileri nedeniyle üretimi ve kullanımı azalmıştır.
| IUPAC Adı | Tetraklorometan |
| Moleküler formül | CCl4 |
| CAS numarası | 56-23-5 |
| Eş anlamlı | Karbon tet, Tetraform, Perklorometan, Tetrasol |
| InChI | InChI=1S/CCl4/c2-1(3,4)5 |
Karbon tetraklorürün özellikleri
Karbon tetraklorür formülü
Karbon tetraklorürün kimyasal formülü CCl4’tür. Dört klor atomuna bağlı bir karbon atomundan oluşan bir molekülü temsil eder. Formül, bileşik içindeki atomların element bileşimi ve düzeni hakkında temel bilgileri sağlar.
Karbon Tetraklorür Molar Kütlesi
Tetraklorometanın molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanır. Karbonun molar kütlesi 12,01 g/mol iken klorun molar kütlesi 35,45 g/mol’dür. Bu değerler toplandığında tetraklorometanın molar kütlesi yaklaşık 153,82 g/mol olur.
Karbon tetraklorürün kaynama noktası
Tetraklorometanın 76,72°C (170,1°F) gibi nispeten yüksek bir kaynama noktası vardır. Bu, standart atmosferik basınçta bileşiğin o sıcaklıkta sıvıdan gaza dönüştüğü anlamına gelir. Kaynama noktası, madde içindeki moleküller arası kuvvetlerin gücünü yansıtır.
Karbon tetraklorür Erime noktası
Tetraklorometanın erime noktası -22,92°C’dir (-9,26°F). Bu, bileşiğin katı formunun sıvıya dönüştüğü sıcaklıktır. Erime noktası, kristal kafes içinde atomları bir arada tutan bağların gücü hakkında bilgi sağlar.
Karbon tetraklorürün yoğunluğu g/mL
Tetraklorometanın yoğunluğu yaklaşık 1,586 g/mL’dir. Yoğunluk, bir maddenin birim hacim başına kütlesini ifade eder. Tetraklorometanın yoğunluğu, yoğunluğu 1 g/mL olan sudan daha yoğun olduğunu gösterir.
Karbon Tetraklorür Molekül Ağırlığı
Tetraklorometanın moleküler ağırlığı, onu oluşturan atomların atom ağırlıkları toplanarak hesaplanır. Bir karbon atomu (12,01 g/mol) ve dört klor atomu (her biri 35,45 g/mol) ile tetraklorometanın moleküler ağırlığı yaklaşık 153,82 g/mol’dür.
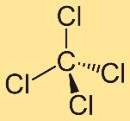
Karbon tetraklorürün yapısı
Tetraklorometanın yapısı dört klor atomuna bağlı merkezi bir karbon atomundan oluşur. Bu klor atomları, karbon atomunun etrafında simetrik olarak konumlandırılarak tetrahedral bir geometri oluşturur. Bu yapı bileşiğin özelliklerine ve davranışına katkıda bulunur.
Karbon tetraklorürün çözünürlüğü
Tetraklorometan suda çok az çözünür ve 20°C’de yaklaşık 0,8 g/L’lik bir çözünürlüğe sahiptir. Ancak etanol, eter ve benzen gibi organik çözücülerde daha yüksek çözünürlük gösterir. Çözünürlük özellikleri moleküller arası kuvvetlerden ve ilgili maddelerin polaritesinden etkilenir.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 1.586 |
| Renk | Yok |
| Koku | Yumuşak |
| Molar kütle | 153,82 gr/mol |
| Yoğunluk | 1.586 g/mL |
| Füzyon noktası | -22,92°C (-9,26°F) |
| Kaynama noktası | 76,72°C (170,1°F) |
| Flaş noktası | Yok |
| sudaki çözünürlük | 20°C’de 0,8 g/L |
| çözünürlük | Etanol, eter ve benzen gibi organik çözücülerde çözünür |
| Buhar basıncı | 20°C’de 11,9 mmHg |
| Buhar yoğunluğu | 5.3 (hava = 1) |
| pKa | Yok |
| pH | Yok |
Karbon tetraklorür güvenliği ve tehlikeleri
Tetraklorometan önemli güvenlik riskleri oluşturur. Oldukça toksik olarak kabul edilir ve insan sağlığına ciddi şekilde zarar verebilir. Buharlarının solunması solunum yolu tahrişine, baş dönmesine, mide bulantısına ve hatta karaciğer ve böbrek hasarına neden olabilir. Sıvı ile cilt teması yanıklara ve tahrişe neden olabilir. Bileşik aynı zamanda uzun vadeli sağlık riskleri oluşturan bilinen bir kanserojendir. Ayrıca tetraklorometan, toprağı ve suyu kirletme potansiyeli nedeniyle çevreye zararlıdır. Bu tehlikeler nedeniyle maruziyeti en aza indirmek ve hem insan sağlığını hem de çevreyi korumak amacıyla üretimi ve kullanımı önemli ölçüde kısıtlanmıştır. Tetraklorometanla ilişkili riskleri azaltmak için uygun taşıma, depolama ve imha protokolleri takip edilmelidir.
| Tehlike sembolleri | T, Xn |
| Güvenlik Açıklaması | Çok zehirli; Zararlı |
| BM kimlik numaraları | 1846 |
| HS kodu | 2903.14.0000 |
| Tehlike sınıfı | 6.1 (Zehirli maddeler) |
| Paketleme grubu | II |
| Toksisite | Akut toksisite, Kanserojen |
Karbon tetraklorürün sentezi için yöntemler
Tetraklorometan farklı yöntemlerle sentezlenebilir. Yaygın bir yöntem, alüminyum klorür (AlCl3) gibi bir katalizör varlığında klor gazı (Cl2) ile karbon disülfür (CS2) arasındaki reaksiyonu içerir.
Bu süreçte klor gazı karbon disülfit buharıyla reaksiyona girerek tetraklorometan ve kükürt üretir. Reaksiyon şu şekilde ilerler:
Cl2 + CS2 → CCl4 + S
Diğer bir yöntem ise metan (CH4) ile klor gazı arasındaki reaksiyonu içerir. Kontrollü koşullar altında metan, ultraviyole (UV) ışık veya ısı varlığında klor ile reaksiyona girerek tetraklorometan ve hidrojen klorür üretir. Reaksiyon şu şekilde ilerler:
CH4 + 4Cl2 → CCl4 + 4HCl
Klorlama maddesi olarak hidrojen klorür (HCl) kullanılarak karbon disülfürün klorlanması tetraklorometan üretir. Bu reaksiyon demir(III) klorür (FeCl3) gibi bir katalizör gerektirir. Reaksiyon şu şekilde ilerler:
CS2 + 3HCl + FeCl3 → CCl4 + S + 2FeCl2
Tetraklorometan sentezlenirken, bileşiğin tehlikeli doğası nedeniyle bireyler dikkatli olmalıdır. Refahlarını sağlamak ve çevre kirliliğini önlemek için sıkı güvenlik önlemleri ve uygun ekipman kullanmalıdırlar.
Karbon tetraklorürün kullanım alanları
Tetraklorometanın benzersiz özelliklerinden çeşitli uygulamalar yararlanmıştır. İşte bazı kullanımları:
- Çözücü: Tetraklorometan, yağları, gresleri, kauçukları ve balmumlarını çözdüğünde solvent görevi görür. Ancak toksisitesi ve çevresel kaygıları solvent kullanımını önemli ölçüde azaltmıştır.
- Yangın Söndürücü: Tetraklorometan, elektrikli ekipman ve yanıcı sıvıların dahil olduğu belirli yangın türlerini söndürmek için kullanılır. Daha güvenli alternatifler ve bunların zararlı etkileri, kullanımının kademeli olarak terk edilmesine yol açmıştır.
- Kimyasal ara madde: Tetraklorometan, soğutucular, pestisitler ve farmasötikler gibi çeşitli bileşiklerin üretiminde kimyasal bir ara madde olarak görev yapmıştır.
- Temizlik maddesi: Endüstriler daha önce metal yüzeyler ve elektronik bileşenler için temizlik maddesi olarak tetraklorometan kullanıyordu. Ancak sağlık ve çevresel riskler daha güvenli alternatiflerin tercih edilmesine yol açmıştır.
- Laboratuvar reaktifi: Tetraklorometan bazen laboratuvardaki spesifik reaksiyonlar ve ekstraksiyonlar için reaktif veya çözücü olarak kullanılır. Kimyacılar genellikle daha güvenli alternatifleri tercih etmekte ve bunların kullanımını sınırlandırmaktadır.
Tetraklorometanın insan sağlığı ve çevre üzerindeki zararlı etkileri nedeniyle bu uygulamaların çoğunun azaldığını, hatta tamamen durdurulduğunu belirtmek önemlidir. Sonuç olarak, tetraklorometanın kullanımı önemli ölçüde azalmış ve çeşitli endüstrilerde daha az toksik ve çevreye daha az etkili olan alternatif maddeler benimsenmiştir.
Sorular:
S: Hala karbon tetraklorürün yerine geçen ürünleri satın alabilir misiniz?
C: Evet, tetraklorometanın daha güvenli ve çevresel etkisi daha düşük olan alternatifleri var.
S: Hala karbon tetraklorür satın alabilir misiniz?
C: Tetraklorometan, toksisitesi ve çevresel riskleri nedeniyle birçok ülkede kısıtlanmıştır, bu nedenle satın alınabilirliği sınırlıdır.
S: Karbon tetraklorür yasal mı?
C: Tetraklorometan, sağlığa ve çevreye zararlı etkilerinden dolayı birçok ülkede yasal kısıtlamalara tabidir.
S: Karbon tetraklorür alkali mi yoksa asit mi?
C: Tetraklorometan ne alkali ne de asidiktir; nötr bir bileşiktir.
S: Karbon tetraklorür polar mı yoksa polar değil mi?
C: Tetraklorometan simetrik tetrahedral yapısından dolayı polar olmayan bir moleküldür ve bu da elektronların eşit paylaşımına neden olur.
S: Karbon tetraklorürün molar kütlesi nedir?
A: Tetraklorometanın molar kütlesi yaklaşık 153,82 g/mol’dür.
S: Karbon tetraklorür nedir?
C: Tetraklorometan, geçmişte öncelikli olarak solvent olarak kullanılan renksiz bir sıvı bileşiktir ancak toksisitesi ve çevresel kaygılar nedeniyle kullanımı artık sınırlıdır.
S: Karbon tetraklorürün kimyasal formülü nedir?
C: Tetraklorometanın kimyasal formülü CCl4’tür.
S: Bağ karbon tetraklorürde mi?
C: Tetraklorometandaki bağ kovalenttir ve merkezi karbon atomu ile çevredeki klor atomları arasında dört kovalent bağ bulunur.
S: Karbon tetraklorür iyonik mi yoksa kovalent mi?
C: Tetraklorometan kovalent bir bileşiktir çünkü karbon ve klor atomları arasında elektronları paylaşarak bağlar oluşturur.
Soru: Karbon tetraklorür molekülünde kaç tane klor atomu vardır?
C: Tetraklorometan molekülünde dört klor atomu vardır.
S: Her bir çözünen madde için en iyi çözücüyü belirleyin: su mu yoksa karbon tetraklorür mü?
C: En iyi çözücü çözünen maddeye bağlıdır. Su genellikle polar maddeler için daha iyi bir çözücüdür, tetraklorometan ise polar olmayan maddeler için daha iyidir.
S: Tetraklorometanın Lewis yapısı?
C: Tetraklorometanın Lewis yapısında, merkezi karbon atomu dört klor atomuna bağlıdır ve merkezi karbon atomunda yalnız çift yoktur.
